XiaoMi-AI文件搜索系统
World File Search System打击洗钱、资助恐怖主义和资助大规模杀伤性武器扩散的国家战略
作为一家声誉卓著的国际金融中心 (IFC),我们非常重视所有金融犯罪。我们的法院已经认识到,泽西岛作为国际金融中心的利益要求判处的刑罚具有威慑力,我们的执法机构严格调查金融犯罪指控。同样,我们的金融服务监管机构泽西岛金融服务委员会继续将打击和预防金融犯罪作为优先事项,同时致力于监管其监管的行业。我们还认识到泽西岛作为国际金融中心在与国际合作伙伴合作打击往往跨境的金融犯罪方面发挥的重要作用。
通过操作提高弹性和杀伤力...
根据美国法典第 10 章中的预算认证要求。§2926,国防部每年量化各军事部门和国防部门的运营能源投资,并评估总统预算与运营能源战略三个目标的一致性。ASD(维持)判断 2022 财年总统预算足以满足之前的运营能源战略,并在 2021 日历年年底前提供了这一评估。展望未来,ASD(维持)将继续严格审查运营能源投资的充分性和方向。减少现有舰队的燃料消耗 2022 财年总统预算包括 13.15 亿美元,用于改善现有平台的能源使用。相对于前任总统的预算,2022 财年预算请求包括对现有飞机和船舶的 8000 多万美元额外投资。
对选定的生存力和杀伤力测试数字技术开发和实施项目进行评估
本报告确定了参与开发和演示数字技术使用所需活动的选定项目,这些技术是实现全频谱生存力和杀伤力评估所必需的。全频谱生存力和杀伤力评估旨在扩大所涵盖系统的生存力和杀伤力测试范围,不仅包括针对动能威胁的测试,还包括针对非动能威胁的测试,例如网络威胁、定向能武器、电磁频谱火力以及化学、生物、放射和核威胁。全频谱生存力和杀伤力评估还旨在利用数字技术在系统的整个生命周期内对生存力和杀伤力进行评估,因为部署的系统和威胁都会随着时间的推移而不断发展。本报告是根据《2022 财年国防授权法案》(NDAA)第 223 条编写的,该条要求部长与相关官员协调,开发:(1)数字技术,以便对美国法典第 10 篇第 2366 条(现为 4172 条)要求的实弹测试进行建模和仿真,以及(2)使用物理实弹测试数据来指导和改进此类数字技术的过程。部长通过作战测试和评估(DOT&E)主任评估并选择不少于三家公司参与本指令要求的演示活动。更具体地说,主任应选择:(1)陆军至少选择一个这样的项目;(2)海军或海军陆战队至少选择一个这样的项目;(3)空军或太空部队至少选择一个这样的项目。为了满足国会的这项指令,DOT&E 对指定用于实弹测试和评估的涵盖系统进行了调查。 DOT&E 评估认为,已使用数字技术的实弹测试和评估项目最适合:(1)成功展示如何使用数字技术实现全方位的生存力和杀伤力评估,以及(2)确定需要解决的任何不足,以成功建立使用数字工程的全方位生存力和杀伤力评估流程,作为实弹测试和评估的未来标准。因此,DOT&E 选择了以下四个项目参与所需活动,以开发和展示数字技术如何实现全方位的生存力和杀伤力评估:1. 未来远程突击机,符合国会要求,至少包括一项来自陆军的此类项目。未来远程突击机项目正在提供该飞机的数字模型及其驾驶舱的模拟器,这两者都被评估为全方位生存力评估的推动者。该计划打算在整个采购生命周期中使用数字孪生,以支持对支持持续评估生存能力的过程进行评估,因为系统和威胁都在不断发展。该计划还实施了系统理论过程分析,可用于开发基于任务的高级风险评估,以进行全频谱生存能力评估。该计划是中间层采购途径的一个示例,可以展示如何实现全频谱生存能力,而不管采购途径如何。最后,该计划处于初始开发阶段,允许
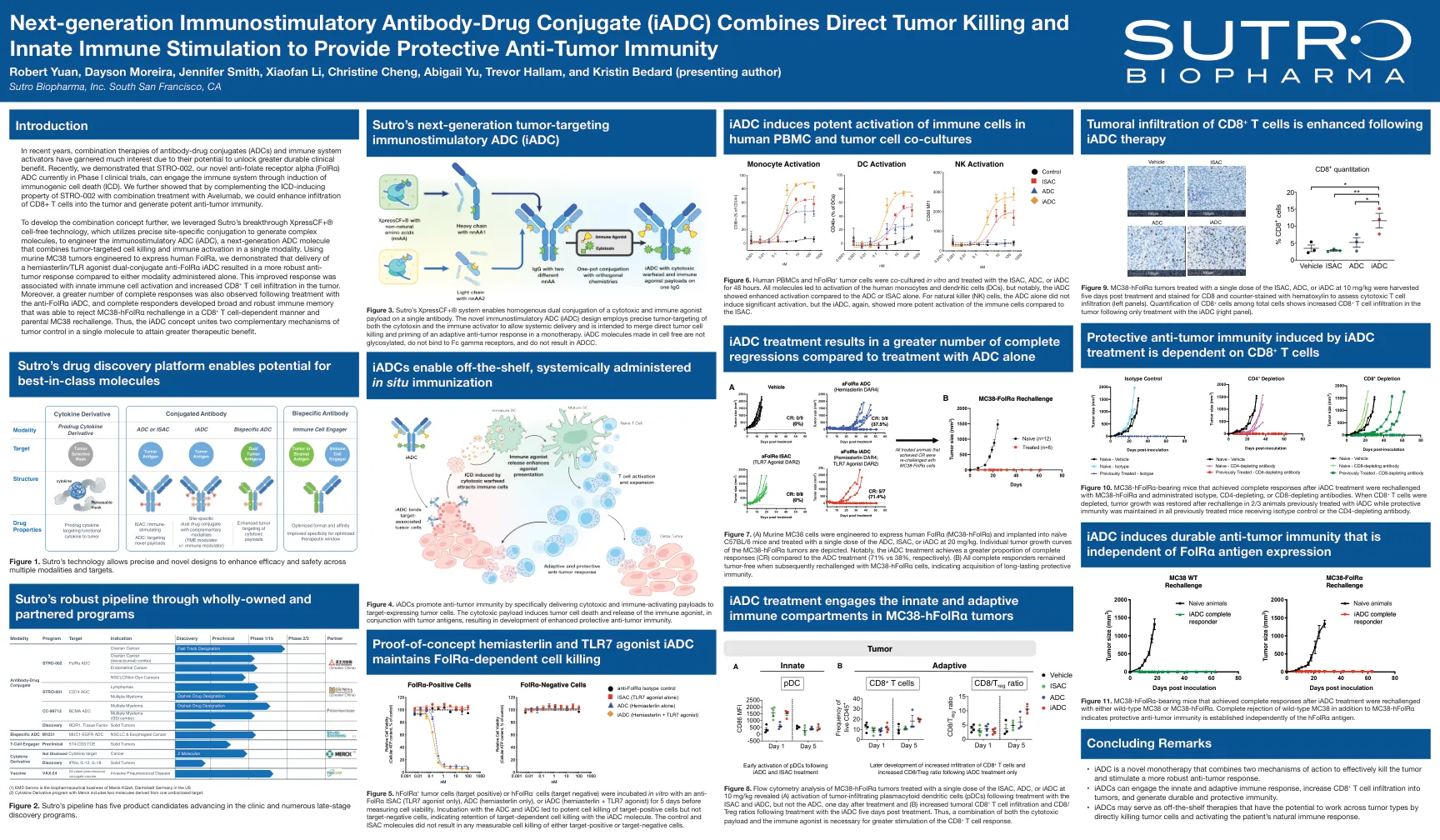
下一代免疫刺激抗体-药物偶联物 (iADC) 结合直接肿瘤杀伤和先天免疫刺激,提供保护性抗
为了进一步开发组合概念,我们利用 Sutro 的突破性 XpressCF+® 无细胞技术,该技术利用精确的位点特异性结合来生成复杂分子,以设计免疫刺激性 ADC (iADC),这是一种将肿瘤靶向细胞杀伤和免疫激活结合在单一模式中的下一代 ADC 分子。使用经过设计以表达人类 FolRa 的小鼠 MC38 肿瘤,我们证明,与单独使用任何一种方式相比,使用半胱氨酸/TLR 激动剂双结合抗 FolRα iADC 可产生更强大的抗肿瘤反应。这种改善的反应与先天免疫细胞激活和肿瘤中 CD8 + T 细胞浸润增加有关。此外,在使用抗 FolRα iADC 治疗后还观察到了更多完全反应,完全反应者形成了广泛而强大的免疫记忆,能够以 CD8 + T 细胞依赖的方式拒绝 MC38-hFolRα 再挑战和亲本 MC38 再挑战。因此,iADC 概念将两种互补的肿瘤控制机制结合在单个分子中,以获得更大的治疗效益。
无人机运送 CBNRECy â•fi DEW 武器 新兴的微型大规模杀伤和破坏性武器 (WMDD) 威胁
推荐引用 推荐引用 Nichols, Randall K.;Sincavage, Suzanne;Mumm, Hans;Lonstein, Wayne;Carter, Candice;Hood, John Paul;Mai, Randall;Jackson, Mark;Monnik, Mike;McCreight, Robert;Slofer, William;以及 Harding, Troy,《无人机运送 CBNRECy – DEW 武器 新兴的微型大规模杀伤和破坏性武器 (WMDD) 威胁》(2022)。NPP 电子书。46。https://newprairiepress.org/ebooks/46
双特异性杀伤力(自行车)靶向抗B7H3 ...
天然杀手(NK)细胞是一种先天淋巴细胞,是肿瘤免疫监视的重要组成部分。实际上,缺乏NK细胞或缺乏NK细胞裂解活性的患者患癌症的风险更高。此外,结局较差的癌症患者的NK细胞数量低或细胞毒性降低。因此,正在为抗肿瘤疗法开发基于NK细胞的免疫疗法。
癌症治疗的合成杀伤力的进步
抽象目的Tepotinib是一种高度选择性,有效的间质 - 上皮过渡因子(MET)抑制剂,批准用于治疗具有MET Exon 14跳过的非小细胞肺癌(NSCLC)。该人群药物的目标(PK)分析是为了评估Tepotinib及其主要循环代谢物MSC2571109A的剂量暴露关系,并识别可预测PK变异性的内在/外在因素。方法数据包括来自12例癌症患者和健康参与者的研究。一种顺序建模方法用于分析父和代谢物数据,包括协变量分析。使用基于自举分析的森林图说明了观察到的协变量与PK参数之间的潜在关联。导致一个两室模型,具有顺序的零和一阶吸收,并且从中央隔室中消除了一阶消除,最好描述了人类在30-1400 mg的剂量范围内tepotinib的等离子体PK。tepotinib的生物可用性被证明是剂量依赖性的,尽管生物利用度主要以500 mg的治疗剂量高于治疗剂量下降。种族,年龄,性别,体重,轻度/中度肝损伤以及轻度/中度肾功能障碍的内在因素以及阿片类镇痛药和吉非替尼的外在因素对Tepotinib PK没有相关作用。tepotinib的有效半衰期约为32小时。结论Tepotinib显示至少至少具有治疗剂量的剂量比例,并且与时间无关的清除率具有适合每日给药的概况。均未确定的协变量对Tepotinib暴露或所需剂量调整具有临床意义。
利用人工智能在网络杀伤链中阻止勒索软件
版权所有 © 2022 Fortinet, Inc. 保留所有权利。Fortinet ® 、FortiGate ® 、FortiCare ® 和 FortiGuard ® 以及某些其他商标是 Fortinet, Inc. 的注册商标,本文中的其他 Fortinet 名称也可能是 Fortinet 的注册和/或普通法商标。所有其他产品或公司名称可能是其各自所有者的商标。本文中包含的性能和其他指标是在理想条件下的内部实验室测试中获得的,实际性能和其他结果可能会有所不同。网络变量、不同的网络环境和其他条件可能会影响性能结果。本文中的任何内容均不代表 Fortinet 的任何约束性承诺,Fortinet 不提供任何明示或暗示的保证,除非 Fortinet 与购买者签订了由 Fortinet 总法律顾问签署的具有约束力的书面合同,该合同明确保证所标识的产品将按照某些明确标识的性能指标运行,并且在这种情况下,只有此类具有约束力的书面合同中明确标识的特定性能指标对 Fortinet 具有约束力。为绝对清楚起见,任何此类保证仅限于在与 Fortinet 内部实验室测试相同的理想条件下的性能。Fortinet 完全否认根据本文做出的任何明示或暗示的契约、陈述和保证。Fortinet 保留在不另行通知的情况下更改、修改、转让或以其他方式修订本出版物的权利,并且最新版本的出版物应适用。