XiaoMi-AI文件搜索系统
World File Search System引用:McGrath KC、Li X、Twigg SM、Heather AK (2020) 载脂蛋白-AI 模拟肽 D-4F 和 L-5F 可减轻 C57BL/6 小鼠的肝脏炎症并增加胰岛素敏感性。PLoS ONE 15(1): e0226931。 https://doi.org/10.1371/ journal.pone.0226931
高密度脂蛋白 (HDL) 的抗炎和抗氧化特性的发现引发了一个问题:HDL 是否可用于治疗疾病中的炎症。胰岛素抵抗主要依赖于肝脏炎症,研究表明,组成性活性肝核因子 κB (NF- κ B)(驱动炎症反应的中枢介质)会导致小鼠模型中的胰岛素抵抗状态 [ 1 ]。我们之前证明,单独(无脂质)或作为含有 PLPC 的重组 HDL(rHDL)的一部分施用载脂蛋白 A-I (apoA-I) 可预防肝脏炎症并改善高脂喂养的 C57Bl/6 小鼠的胰岛素抵抗 [ 2 ]。虽然结果令人鼓舞,但 apoA-I 颗粒的产生很大且耗时。载脂蛋白 A-I (apoA-I) 模拟肽已被开发和设计,其功能类似于全长 apoA-I,但效力更强,药代动力学特征也比全长 apoA-I 更好 [ 3 , 4 ]。这些模拟肽比 rHDL 有许多优势,包括成本相对较低、生产简单,并且能够修改其结构以允许口服给药。ApoA-I 模拟肽的特点是其苯丙氨酸残基附着,苯丙氨酸残基的增加与疏水性的增加及其与磷脂结合的能力相关 [ 4 ]。根据序列中疏水性苯丙氨酸残基的数量,研究最深入的是 4F 和 5F apoA-I 模拟肽。它们具有与 apoA-I 相同的 A 类两亲性螺旋结构 [ 5 ]。D-4F 和 L-5F 的区别在于两亲性螺旋疏水面上存在的苯丙氨酸数量,并且 D-4F 由 D-氨基酸合成,而 L-5F 由 L-氨基酸合成。对于口服给药,与 L-氨基酸相比,D-氨基酸被发现更能抵抗酶促降解。然而,吸收后,D-氨基酸不会降解,这可能导致毒性和其他副作用 [ 6 ]。L-氨基酸在循环中的毒性较小,但它们不能抵抗口服的酶促降解。两者都曾在生物学研究中使用过,据报道具有强大的抗炎和抗氧化作用 [ 7 – 12 ]。我们表明,模拟治疗显着在本研究中,我们直接测试了使用 apoAI 模拟肽 D-4F 和 L-5F 治疗是否可以改善高脂饮食 (HFD) 喂养小鼠的胰岛素敏感性,从而降低肝脏炎症。
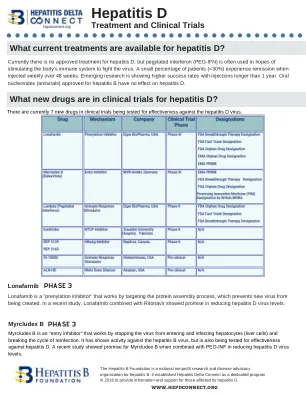
HDV 临床试验情况说明书
依折麦布目前用于降低血液中的胆固醇,目前正在研究其对丁型肝炎的有效性。依折麦布具有药效团特征,可抑制 NTCP,NTCP 是 HBV 和 HDV 进入肝细胞所需的受体。这种化合物被称为“基于核酸的两亲性聚合物”(NAP),可抑制受感染肝细胞释放乙型肝炎表面抗原 (HBsAg),目前正在评估其与 PEG-IFN 联合治疗丁型肝炎病毒的效果。GI-18000 Tarmogen 目前正在研究其对丁型肝炎感染细胞产生 T 细胞免疫反应的有效性,以改善治疗结果。该策略是确定区分患病细胞和正常细胞的分子靶点,并激活免疫系统以选择性地靶向和消灭患病细胞。这种方法正用于乙型肝炎和丁型肝炎病毒,使用干扰和破坏病毒基因组的化合物“沉默”病毒 RNA。
易于合成可访问高熔化的硫的共聚物及其自组装二嵌段共聚物,可从苯基异氰酸酯和氧烷 锂的健康状况和降解模式估计... 对聚磷酸/无机硅酸盐阻燃剂从环氧树脂转移到分层玻璃纤维增强复合材料及其Furnace后弯曲性能的系统研究
摘要:尽管硫磺聚合物承诺具有独特的特性,但其受控的合成,尤其是在复杂且功能性架构方面,仍然具有挑战性。在这里,我们表明氧乙烷和苯基异硫氰酸苯二氮化的共聚物选择性地产生多硫二酰二酰二氧化物,作为一类新的含有分子量分布的硫酸盐,具有窄的分子量分布(m n = 5-80 kg/mol,用 ^ 1.2; mm n,max = 124 kg/mol)和高熔点;五个;氧乙烷和异硫氰酸盐的取代基模式。自核实验表明,苯基取代基,未取代聚合物主链的存在以及动力学控制的链接选择性是最大化熔点的关键因素。对宏链转移剂的耐受性增加和控制的传播允许合成双层晶体和两亲性二嵌段共聚物,可以将其组装成胶束和蠕虫样的结构中,并与水中的无律核心。相比之下,乙醇中结晶驱动的自组装会产生圆柱形胶束或血小板。
审查由肽两亲物形成的纳米结构
肽和蛋白质分别是氨基酸的短链和长链。表达的肽和蛋白质在生物学变异中起着重要而突出的作用,包括控制代谢,调节骨骼代谢,清除自由基,改变睾丸激素水平以及对某些疾病的治疗[1-6]。令人惊讶的是,只有二十个基因编码的氨基酸是自然界中发现的肽的基础,可以将其分为两个主要类别的亲水性和疏水性氨基酸。如方案1所示,ALA,Val,Leu,Ile,Met,Phe,Phe,Tyr和TRP的非极性烃链使它们成为亲脂性,疏水性氨基酸。虽然官能团的存在,例如羟基,酰胺,吡唑,鸟苷,胺,羧酸和硫醇,导致SER,THR,THR,THR,ASN,ASN,GLU,HIS,HIS,LYS,LYS,LYS,LYS,LYS,ASP,ASP,GLU,GLU,GLU,GLU,GLU,GLY,GLY,GLY和CYS的亲水性能(方案2)。这些氨基酸的排列共同导致具有不同亲水性,疏水性或两亲性特性的肽折叠[7]。
具有荧光跟踪的双功能纳米螺旋体及其对肝细胞癌细胞的靶向杀伤作用
最近,针对性的纳米壳的设计用于癌症化学疗法提供了另一种方法。一方面可以通过使用药物包裹的纳米颗粒来拉长血液循环时间并改善肿瘤药物内疏水性药物的生物利用度。另一方面,它可以通过将药物封装的纳米颗粒与靶向配体连接在一起,从而促进肿瘤药物的递送。5,6 These nanovehicles are o en made from macromo- lecular materials such as poly(lactide- co -glycolide) (PLGA), chi- tosan and poly-hydroxyethyl methacrylate/stearic acid, forming dendrimer, liposomes, 7,8 polymers 9 and inorganic nano- particles.10中的壳聚糖(CS)是通过脱乙酰化获得的阳离子自然多糖,是地球上第二大最丰富的生物聚合物损失。11,12 Cs也被称为有希望的生物材料,因为它的生物降解性,无毒性,生物相容性和免疫性。13 - 15但是,CS的水分溶解度差会限制其在药物输送中的应用。16在我们先前的研究中,低分子量的两亲性寡核酸壳可自我组装成水中的纳米细胞,已合成
囊泡:一种有前途的靶向药物输送方法
类囊泡,又称非离子表面活性剂囊泡,是一种小型层状结构,由烷基或二烷基聚甘油醚类非离子表面活性剂与胆固醇结合,然后在水基溶液中水合而成。这些囊泡系统类似于脂质体,可用作两亲性和亲脂性药物的载体。类囊泡的生产工艺源自脂质体技术。基本制造方法保持不变,其中脂质相由水相水合。脂质相可以由纯表面活性剂或表面活性剂和胆固醇的组合组成。类囊泡有效地解决了与药物不溶性、不稳定性、生物利用度不足和快速降解相关的挑战。类囊泡的两亲特性结合了亲水性和亲脂性,增强了其包封亲水性或亲脂性药物的能力。胆固醇经常被用作成分之一。保持囊泡结构的硬度。本文讨论了囊泡的基本要素,包括其结构成分、制造方法及其在不同疾病中的用途。
脂质体的综合综述:作为一种新型药物输送系统
希腊语“Lipos”表示脂肪,“Soma”表示身体,两者组合形成球形同心囊泡,称为脂质体。脂质体是圆形囊状磷脂分子。它包裹水滴,特别是以人工形式将药物运送到组织膜中。脂质体是一种纳米颗粒(尺寸为 100 纳米)[1]。脂质体于 1961 年由 Bangham 首次描述,这是一次偶然的发现,他将磷脂酰胆碱分子分散在水中,在此期间他发现该分子形成封闭的双层形状,具有水相部分,水相部分被脂质双层包裹[2]。脂质体很有用,因为它们可作为多种药物的载体,具有潜在的治疗或其他特性。各种载体(如纳米颗粒、微粒、多糖、凝集素和脂质体)可用于将药物靶向特定部位。脂质体药物输送因其在药物输送、化妆品和生物膜结构等各个领域的贡献而受到人们的关注 [3] 。脂质体是一种微小的气泡(囊泡),其膜由磷脂双层组成。膜通常由磷脂制成,如磷脂酰乙醇胺和磷脂酰胆碱。磷脂是两亲性的,其极性头部为亲水性,烃尾为疏水性 [4] 。
单个小分子组装的线粒体靶向纳米纤维用于增强体内光动力癌症治疗
光动力疗法 (PDT) 已成为癌症治疗中一种有吸引力的替代方法,但由于小分子光敏剂的非选择性亚细胞定位和肿瘤内滞留性差,其治疗效果受到限制。本文报道了一种由靶向两亲性小分子的线粒体组成的纤维形成纳米光敏剂 (PQC NF)。利用特定的线粒体靶向性,光激活的 PQC NF 在细胞中产生的活性氧 (ROS) 量比游离光敏剂高出约 110 倍,并可显著诱导线粒体破坏以引发强烈细胞凋亡,其体外抗癌效力比传统光敏剂高 20-50 倍。作为纤维状纳米材料,PQC NF 还表现出在肿瘤部位的长期滞留性,解决了快速清除肿瘤中小分子光敏剂的难题。凭借这些优势,PQC NF 仅需一次给药即可在皮下和原位口腔癌模型中实现 100% 的完全治愈率。这种单一小分子组装的线粒体靶向纳米纤维为改善传统 PDT 的体内治疗效果提供了一种有利的策略。
巨型两亲物的组装
基于有机尾巴中具有不同刚度的不同刚性的三组聚二碱(POM)的两亲性杂交大分子用作模型,以了解分子刚性在自组装过程中可能的自我认知功能的分子刚度对其可能的自我认识的影响。在两个结构相似的球形rigid T形T形连接的寡素(TOF 4)杆的混合溶液中实现了自我识别,分别是Anderson(Anderson-TOF 4)和Dawson(Dawson-Tof 4),而亲水群是Anderson(Anderson-TOF 4)。Anderson-TOF 4被观察到自组装成洋葱样的多层结构,而Dawson-tof 4形式的多层囊泡。自组装由疏水棒的互插和带电的亲水性无机簇中的反座介导的吸引力。当疏水块不太刚性时,例如部分刚性的聚苯乙烯和完全灵活的烷基链时,未观察到自识别,这归因于疏水性分子在杂质域中的疏水构象。这项研究表明,由于溶性结构域的刚性,由于超分子结构的几何限制可以实现两亲物之间的自我识别。
Wrap-Asmmetric-Triplex-Metallohelices-stabilise-dna-g ...
抽象一些具有大小,形状,电荷和两亲性体系结构类似于短阳离子A-螺旋肽的大小,形状,电荷和两亲性体系结构的 已显示出靶向和稳定DNA G四链体(G4S)的靶向和稳定,并在体外稳定了G4调节基因在人类细胞中的表达。 扩大可以充当有效的DNA G4粘合剂并下调包含G4形成序列的基因的金属结构库,我们调查了两个对映体对对映体的相互作用的相互作用C-Myc,C-Kit和K-Ras Oncogenes。 在所有研究的G4形成序列中,金属纤维表现出比双链DNA的优先结合,并在包含G4形成序列的模板链上诱导了DNA聚合酶的诱导停滞。 此外,如RT-QPCR分析和蛋白质印迹揭示了研究的Myallohelices在HCT116人类癌细胞中mRNA和蛋白水平上抑制了C-MYC和K-RAS基因在mRNA和蛋白水平上的表达。已显示出靶向和稳定DNA G四链体(G4S)的靶向和稳定,并在体外稳定了G4调节基因在人类细胞中的表达。 扩大可以充当有效的DNA G4粘合剂并下调包含G4形成序列的基因的金属结构库,我们调查了两个对映体对对映体的相互作用的相互作用C-Myc,C-Kit和K-Ras Oncogenes。 在所有研究的G4形成序列中,金属纤维表现出比双链DNA的优先结合,并在包含G4形成序列的模板链上诱导了DNA聚合酶的诱导停滞。 此外,如RT-QPCR分析和蛋白质印迹揭示了研究的Myallohelices在HCT116人类癌细胞中mRNA和蛋白水平上抑制了C-MYC和K-RAS基因在mRNA和蛋白水平上的表达。已显示出靶向和稳定DNA G四链体(G4S)的靶向和稳定,并在体外稳定了G4调节基因在人类细胞中的表达。扩大可以充当有效的DNA G4粘合剂并下调包含G4形成序列的基因的金属结构库,我们调查了两个对映体对对映体的相互作用的相互作用C-Myc,C-Kit和K-Ras Oncogenes。在所有研究的G4形成序列中,金属纤维表现出比双链DNA的优先结合,并在包含G4形成序列的模板链上诱导了DNA聚合酶的诱导停滞。此外,如RT-QPCR分析和蛋白质印迹揭示了研究的Myallohelices在HCT116人类癌细胞中mRNA和蛋白水平上抑制了C-MYC和K-RAS基因在mRNA和蛋白水平上的表达。