XiaoMi-AI文件搜索系统
World File Search System半导体加工安全 - 证书
半导体加工安全课程让毕业生掌握安全处理半导体制造相关化学品和工艺所需的技能。随着对机器学习、人工智能和云计算的需求不断增长,半导体和集成芯片的生产也不断增加,而这些芯片的安全可靠生产需要既有被动安全策略,也有主动安全策略。该课程的毕业生不仅能够确保现有工艺的安全,而且还有机会在半导体加工的诸多领域建立安全原则,因为这些领域正在不断扩展和创新。
2024 年 11 月 14 日 081-68W-0401 操作流体加温器状态
条件:在临床或操作环境中,您已收到医疗命令,通过静脉输液提供加热静脉 (IV) 溶液、血液或血液制品。所有其他直接生命威胁都已得到治疗和处理。您已经进行了患者护理洗手并进行了身体物质隔离。您将获得患者的临床记录、血液液体加温系统、IV 溶液、血液或血液制品、酒精垫、胶带、笔和国防部表格 1380(战术战斗伤亡护理 (TCCC) 卡)、标准表格 (SF) 510(护理记录)(如果有)或 SF 600 医疗记录-医疗护理的时间记录或电子医疗记录 (EMR)。此任务不应在 MOPP 4 中进行培训。标准:按照 (IAW) 制造操作程序、战术战斗伤亡护理 (TCCC) 指南操作液体加热器;由联合创伤系统 (JTS) 战术战斗伤员救治委员会 (CoTCCC) 进行,同时遵守所有警告和注意事项,使用任务通过/不通过清单准确无误。特殊条件:在训练此任务时,领导者应结合使用陆军条令的八个相互关联的作战变量的情景/情况:政治;军事;经济;社会;信息;基础设施;物理环境,时间,(PMESII-PT),以教育士兵了解作战环境 (OE) 意识,强化价值观,并解决当前的陆军问题,以完善士兵对陆军作战的理解。几乎每场冲突中都会出现 PMESII-PT 变量,它们是 OE 的基石。它们可以相互关联、重叠,并共同作为理解 OE 的基础。安全风险:低 MOPP 4:从不
同种异体加工的胸腺组织-AGDC(Rethymic®)
简介Rethymic®由培养的胸腺组织(CTT)组成,该组织被处理以保留胸腺上皮细胞并耗尽大多数供体胸腺细胞,然后再将胸膜细胞植入接受者Quadriceps肌肉中的口袋。ctt的作用与正常胸腺组织相似,产生免疫功能的幼稚T细胞(CD3+ CD4+ CD45RA+ CD62L+和CD3+ CD8+ CD8+ CD45RA+ CD62L+细胞),可以迁移到外围,并以CD3+ CD4+ CD4+ CD3+ CD3+ CD8+ CD8+ CD8+细胞迁移。在CTT移植后,受体骨髓干细胞转到移植组织以发展为受体T细胞。受体树突状细胞删除了与树突状细胞过于结合的任何发育中的胸腺细胞或CTT中供体胸上皮的结合。没有T细胞会攻击受体或CTT离开胸腺。 天真的T细胞出现在植入后6个月和12个月之间的外周血中出现(Markert,2022)。 再生剂量取决于组织切片的总表面积和受体的身体表面积(BSA)。 将切片定义为单个滤膜上的内容。 建议的剂量范围是每m 2受体BSA的再生表面积2至22,000 mm 2。 根据制造商预先计算的特定患者(FDA,Rethymic全处方信息,2021年),在单剂量单位中最多提供42片切片。 Markert及其同事(2022)在1993年至2020年中证明了10个前瞻性,单中心的开放标签研究的功效。 总共招募了105名患者并接受了CTT移植。 呼吸衰竭是负责的原因没有T细胞会攻击受体或CTT离开胸腺。天真的T细胞出现在植入后6个月和12个月之间的外周血中出现(Markert,2022)。再生剂量取决于组织切片的总表面积和受体的身体表面积(BSA)。将切片定义为单个滤膜上的内容。建议的剂量范围是每m 2受体BSA的再生表面积2至22,000 mm 2。根据制造商预先计算的特定患者(FDA,Rethymic全处方信息,2021年),在单剂量单位中最多提供42片切片。Markert及其同事(2022)在1993年至2020年中证明了10个前瞻性,单中心的开放标签研究的功效。总共招募了105名患者并接受了CTT移植。呼吸衰竭是负责,除先天性小没有小没有小没有障碍和/或接受了先前的治疗外,有10名患者有诊断。中包括95例。For inclusion, patients had to have athymia as defined by flow cytometry demonstrating a circulating CD3+ CD45RA+CD62L+ T cell count lower than 50/mm 3 or less than 5% of the total T cell count on 2 separate flow cytometry analyses (1 performed within 3 months and 1 performed within 1 month before administration of CTT), unless they were enrolled in the expanded access protocol, according to which the naïve T cell计数可能高于50mm 3。其他关键资格标准包括CDGA或FOXN1缺乏症以及与SCID相关的遗传缺陷。排除标准包括在给药前4周内进行心脏手术,外科医生或麻醉医生确定的手术不良,HIV感染,事先尝试进行免疫结构,呼吸机依赖性和巨细胞病毒(CMV)感染,需要用于需要免疫抑制的患者。免疫抑制是根据对植物凝集素(PHA)的增生反应,无论典型或非典型表型。在疗效分析集(EAS)中,有95例先天性胸肌患者中有93例CDGA诊断和2例FOXN1缺乏症。Kaplan-Meier估计在收到CTT后1年和2年内EA的生存率分别为77%和76%。 EA的中位随访时间为7。6年,范围从0到25。5年。 CTT移植后约1-2年,T细胞计数达到了峰值。Kaplan-Meier估计在收到CTT后1年和2年内EA的生存率分别为77%和76%。EA的中位随访时间为7。6年,范围从0到25。5年。CTT移植后约1-2年,T细胞计数达到了峰值。对于收到CTT后1年活着的患者,中位随访时间为10.9岁的估计存活率为93%。幼稚的T细胞数量从所有患者开始为0,并在2年内增加到最高数量。通过对有丝分裂原和抗原的增生反应研究 T细胞功能。 在大多数患者中, b细胞和NK细胞计数保持在正常范围内,几乎所有患者都能够阻止IgG替代疗法(Markert,2022)。 有105例患者,有32例至少有1例严重不良事件的患者,35例至少有1例威胁生命的不良事件,以及26例与事件有关的死亡。 总共有53例患者被归类为严重,13例被归类为威胁生命,11例患有致命感染。 在CTT移植后的第一年,总共报道了78种新的病毒感染。 105例患者中共有28例死亡;由于CTT移植后进行了SCID诊断,因此认为26例与不良事件有关,另有2例报告在研究后报告。 在移植后的第一年,在28例死亡中,22例死亡(包括13例与感染有关的死亡中的12例)发生,而患者仍然是免疫缺陷的。T细胞功能。b细胞和NK细胞计数保持在正常范围内,几乎所有患者都能够阻止IgG替代疗法(Markert,2022)。有105例患者,有32例至少有1例严重不良事件的患者,35例至少有1例威胁生命的不良事件,以及26例与事件有关的死亡。总共有53例患者被归类为严重,13例被归类为威胁生命,11例患有致命感染。在CTT移植后的第一年,总共报道了78种新的病毒感染。105例患者中共有28例死亡;由于CTT移植后进行了SCID诊断,因此认为26例与不良事件有关,另有2例报告在研究后报告。在移植后的第一年,在28例死亡中,22例死亡(包括13例与感染有关的死亡中的12例)发生,而患者仍然是免疫缺陷的。
建模玻璃体加权结构份 -
解决蛋白质折叠问题。这些方法在自然语言处理字段中使用变压器模型来解释以多个序列比对(MSA)(MSA)的共同进化性化来映射到其晶体样结构的主要序列。替代模型,例如omegafold [8]和Esmfold [9],使用蛋白质语言模型(PLM)来绕过MSA的要求。最近,Alphafold3(AF3)[10]将其预测能力扩展到包括蛋白质,核酸,小分子,离子等的复杂结构。尽管这些方法存在于“序列结构 - 功能”范式中,但已经开发了基于这些方法的广泛方法,可以通过修改AF2的输入或先验信息来从“序列 - 元件功能”的角度运行。它们包括MSA-子采样[11]或还原MMSA-AF2(RMSA-AF2),通过从MSA中随机采样序列来减少输入AF2的信息,这些序列会根据序列相似性[12],Speach_AF [13]与MSA的usa use clustions clusters clusters clusters clusterions clustimation cluse speach_af [13] pertrultiants the MSA,并且更多地基于MSA,并且更多的是群集群体,并且会群众群体群体群体群体/更多。方法[14]。此外,通过利用AF2结构,Diffold [15]方法使用扩散框架来采样异质构象。我们指出了Sala等人的评论文章。[16]有关这些方法和其他方法的详细信息。然而,大多数生物分子功能取决于适用于给定环境变量(例如温度,压力和离子浓度)的精确构象分布。因此,不仅需要获得任何分布,而且需要获得玻璃体加权分配的构象的分配,以准确地构象对环境条件。这是通过多种方式完成的,包括通过直接开发基于AI的采样器或使用AI来增强增强的MD。这确保系统探讨了按照热力学原理在给定温度和压力下在给定温度和压力下的正确相对概率和波动的构象。这些玻尔兹曼的重量为变构网络作品和下游生物分子功能提供了见解[17],还减少了通过对接和其他应用程序发现药物发现的亚稳态构象的搜索空间[18](图1C)。在这次微型审查中,我们将讨论在过去几年中为生物分子构象分布的传统甲基动物的影响,并进一步概述了我们认为社区可以采取的鲍尔茨曼(Boltzmann)加权蛋白质及其复合物的结构合成的关键步骤。
无化学的反应性熔体加工生物源聚聚(丁烯 - 核酸氨基酸酯),以提高机械性能和可回收性
摘要:生物化和可生物降解的聚酯等聚酯(丁基琥珀酸酯 - 丁二烯脂肪酯)(PBSA)正在成为单使用应用的油基热塑料的有希望的替代品。然而,PBSA的机械性和流变特性受其在熔体加工过程中的热机械灵敏度的影响,也阻碍了PBSA机械回收。传统的反应性熔体加工(RP)方法使用化学添加剂来抵消这些缺点,从而损害了可持续性。这项研究提出了一种在PBSA融化过程中的绿色反应性方法,基于对其热量降解行为的全面理解。在熔体加工过程中控制的降解路径的假设下可以促进分支/重组反应而不添加化学添加剂,我们旨在增强PBSA流变学和机械性能。使用内部批处理器进行了对PBSA的在线流变行为的深入研究,探索参数,例如温度,螺丝旋转速度和停留时间。评估了它们对PBSA链剪辑,分支/重组和交联反应的影响,以确定有效RP的最佳条件。结果表明,特定的处理条件,例如12分钟的处理时间,200°C温度和60 rpm的螺丝旋转速度,促进了PBSA中长链分支结构的形成。RP策略还改善了PBSA机械回收,从而使其成为低密度聚乙烯(LDPE)的潜在替代品。这些结构变化导致反应PBSA流变学和机械性能的显着增强,弹性模量增加了23%,屈服强度增加了50%,张力强度提高了80%。最终,这项研究表明了反应性熔体加工过程中热机械降解的高度控制可以改善材料的性能,从而实现可靠的机械回收,这可以作为其他可生物降解聚合物的绿色方法。关键词:PBSA,可生物降解聚合物,绿色反应性加工,化学修饰,回收,机械性能,NMR,生物饲养聚合物■简介
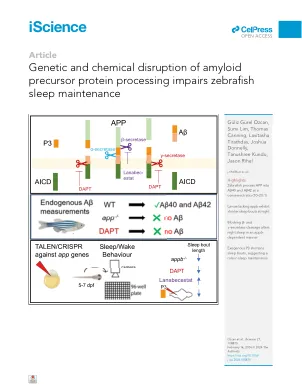
淀粉样蛋白前体加工的基因和化学破坏会损害斑马鱼的睡眠维持
摘要 淀粉样蛋白前体 (APP) 是一种富含大脑的单次跨膜蛋白,可水解加工成多种产物,包括淀粉样蛋白-β (A b ),它是阿尔茨海默病 (AD) 的主要驱动因素。尽管 APP 的过度表达和外源性 A b 都会导致睡眠变化,但 APP 加工是否在调节睡眠中起内源性作用尚不清楚。在这里,我们证明 APP 加工成 A b 40 和 A b 42 在斑马鱼中是保守的,然后描述了功能丧失的 appa 和 appb 突变体的睡眠/觉醒表型。appa 突变的幼虫觉醒活动减少,而缺乏 appb 的幼虫夜间睡眠时间缩短。用 g -分泌酶抑制剂 DAPT 治疗也缩短了夜间睡眠时间,而 BACE-1 抑制剂 lanabecestat 延长了睡眠时间。脑室内注射 P3 也缩短了夜间睡眠时间,这表明 Appb 蛋白水解加工的适当平衡是斑马鱼维持正常睡眠所必需的。
评论文章染色体加倍方法...
双单倍体技术旨在生成纯种自交系,用于基础研究和商业栽培品种。双单倍体技术首先生成单倍体植物,然后进行染色体加倍,根据每个物种的程序,染色体加倍可以分开进行,也可以重叠进行。长期以来,人们一直致力于通过雄核发育、雌核发育或孤雌生殖来生产单倍体。获得单倍体植物是第一步,由于这通常需要进一步优化,染色体加倍方法的研究已经落后。然而,染色体加倍最近重新引起了人们的兴趣,人们通过试验和优化不同的程序来提高双单倍体植物的生产率和效率。人们正在研究新的抗有丝分裂化合物和应用方法,以确保在单倍体材料再生后染色体加倍成功。此外,单倍体诱导物介导的 CRISPR/Cas9 基因组编辑系统是生产单倍体植物材料的突破性方法,对于传统单倍体再生方法无法成功的物种或顽固物种可能具有重要意义。在所有情况下,该系统的新部署都需要合适的染色体加倍方案。在这篇评论中,我们探索了现有的双单倍体和染色体加倍方法,以确定增强主要作物育种过程的机会。
质子辐照在 GaAs 半导体加速辐射老化研究中的应用
摘要:几十年来,质子辐照实验一直被用作研究多种材料辐射效应的替代方法。质子加速器的丰富性和可及性使这种方法便于进行加速辐射老化研究。然而,开发具有更高辐射稳定性的新材料需要大量的模型材料、测试样品,并非常有效地利用加速器光束时间。因此,最佳束流或粒子通量的问题至关重要,需要充分了解。在这项工作中,我们使用 5 MeV 质子在砷化镓样品中引入位移损伤,并使用了广泛的通量值。正电子湮没寿命谱用于定量评估辐射诱导的存活空位的浓度。结果表明,质子通量在 10 11 和 10 12 cm − 2 .s − 1 之间会导致 GaAs 半导体材料中产生类似的单空位浓度,而通量进一步增加会导致该浓度急剧下降。
用抗PD-1抗体加上贝伐单抗治疗的不可切除的肝细胞癌患者的早期肿瘤反应评估的不同放射学标准
1 1 (研发)消化系统肿瘤药物,中国医学科学院和北京联合医学院,中国北京,4医学肿瘤学系,国家癌症中心/国家癌症/癌症医院国家临床研究中心,中国医学科学和北京联合医学院,北京1 (研发)消化系统肿瘤药物,中国医学科学院和北京联合医学院,中国北京,4医学肿瘤学系,国家癌症中心/国家癌症/癌症医院国家临床研究中心,中国医学科学和北京联合医学院,北京(研发)消化系统肿瘤药物,中国医学科学院和北京联合医学院,中国北京,4医学肿瘤学系,国家癌症中心/国家癌症/癌症医院国家临床研究中心,中国医学科学和北京联合医学院,北京(研发)消化系统肿瘤药物,中国医学科学院和北京联合医学院,中国北京,4医学肿瘤学系,国家癌症中心/国家癌症/癌症医院国家临床研究中心,中国医学科学和北京联合医学院,北京(研发)消化系统肿瘤药物,中国医学科学院和北京联合医学院,中国北京,4医学肿瘤学系,国家癌症中心/国家癌症/癌症医院国家临床研究中心,中国医学科学和北京联合医学院,北京(研发)消化系统肿瘤药物,中国医学科学院和北京联合医学院,中国北京,4医学肿瘤学系,国家癌症中心/国家癌症/癌症医院国家临床研究中心,中国医学科学和北京联合医学院,北京(研发)消化系统肿瘤药物,中国医学科学院和北京联合医学院,中国北京,4医学肿瘤学系,国家癌症中心/国家癌症/癌症医院国家临床研究中心,中国医学科学和北京联合医学院,北京(研发)消化系统肿瘤药物,中国医学科学院和北京联合医学院,中国北京,4医学肿瘤学系,国家癌症中心/国家癌症/癌症医院国家临床研究中心,中国医学科学和北京联合医学院,北京(研发)消化系统肿瘤药物,中国医学科学院和北京联合医学院,中国北京,4医学肿瘤学系,国家癌症中心/国家癌症/癌症医院国家临床研究中心,中国医学科学和北京联合医学院,北京(研发)消化系统肿瘤药物,中国医学科学院和北京联合医学院,中国北京,4医学肿瘤学系,国家癌症中心/国家癌症/癌症医院国家临床研究中心,中国医学科学和北京联合医学院,北京(研发)消化系统肿瘤药物,中国医学科学院和北京联合医学院,中国北京,4医学肿瘤学系,国家癌症中心/国家癌症/癌症医院国家临床研究中心,中国医学科学和北京联合医学院,北京(研发)消化系统肿瘤药物,中国医学科学院和北京联合医学院,中国北京,4医学肿瘤学系,国家癌症中心/国家癌症/癌症医院国家临床研究中心,中国医学科学和北京联合医学院,北京(研发)消化系统肿瘤药物,中国医学科学院和北京联合医学院,中国北京,4医学肿瘤学系,国家癌症中心/国家癌症/癌症医院国家临床研究中心,中国医学科学和北京联合医学院,北京