XiaoMi-AI文件搜索系统
World File Search System开发用于研究帕金森病的多传感器集成中脑类器官芯片平台
图 2:芯片上嵌入 hMO 的明场图像 (A)。沿施加的流动方向排列的神经胶质和神经元突起:TH(红色)、GFAP(绿色)、MAP2(洋红色)(B)。芯片上中脑微组织的生长曲线。通过混合效应分析和 Tukey 检验确定的统计学意义 *p<0.033、**p<0.002、***p<0.001(n=8-10,来自 3 个独立的类器官代)(C)。静态(上图)和动态(下图)培养的 hMO 的明场图像描绘了神经突生长的差异(左图)(D)。静态和动态培养的 hMO 的最大神经突生长率的箱线图。通过 Mann-Whitney 检验确定的统计学意义 *p<0.033、**p<0.002、***p<0.001。 (n >= 3,来自 3 个独立的类器官代)(F)。显微照片和 hMO 免疫组织化学染色切片的相应定量分析显示分化 35 天后凋亡标志物 caspase 3 存在显著差异。通过 Welch t 检验确定统计学意义 *p<0.033、**p<0.002、***p<0.001。柱状图和误差线表示平均值 ± SEM(n >= 3,来自 3 个独立的类器官代)(E、G)。分化 60 天后的完整中脑类器官:TH(红色)、GFAP(绿色)、MAP2(洋红色)、细胞核(蓝色)(H)。放大 60 倍的完整 hMO 核心的放大细节(H)(I)。MAP2 阳性神经元的免疫荧光染色(J)。 GFAP 阳性星形胶质细胞的免疫荧光染色 (K)。TH 阳性多巴胺能神经元的免疫荧光染色 (L)。中脑类器官中神经黑色素聚集体的明场图像 (右图) 和相应的 Fontana Masson 染色显示细胞内和细胞外神经黑色素聚集 (左图) (M)。
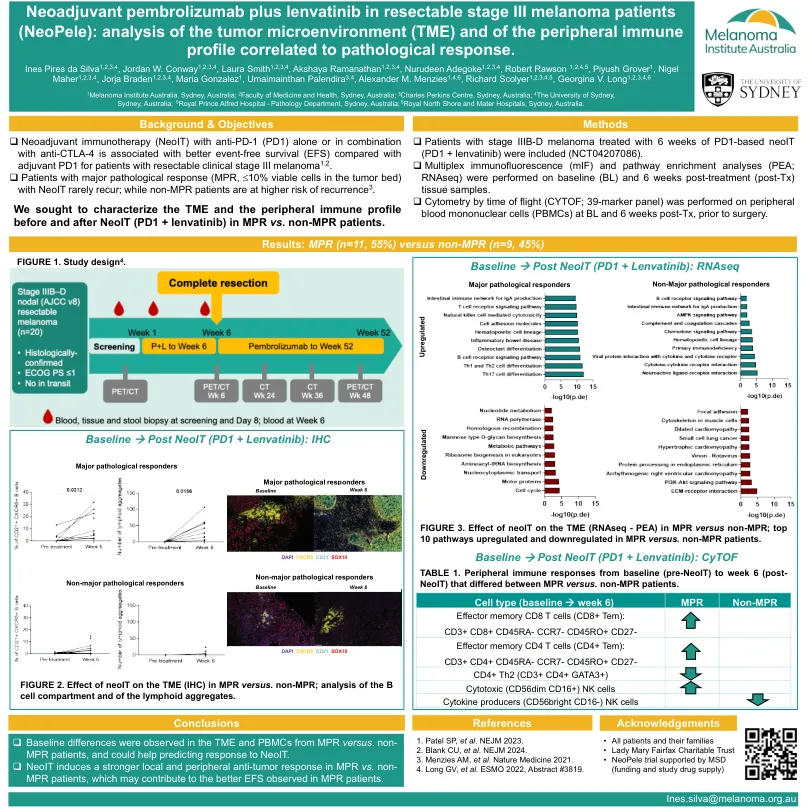
Neoadjuvant pembrolizumab加上可切除的III期黑色素瘤患者(Neopele)的Lenvatinib:肿瘤微环境(TME)和
包括6周基于PD1的NEOIT(PD1 + Lenvatinib)治疗的IIIB-D期黑色素瘤患者(NCT04207086)。多重免疫荧光(MIF)和途径富集分析(PEA; RNASEQ)在基线(BL)和治疗后6周(TX)组织样品上进行。按飞行时间(cytof; 39标记面板)进行的细胞仪在BL和TX后6周对外周血单核细胞(PBMC)进行手术前进行。
多功能的Wnt调节器是啮齿动物条纹模式的演变
信件和材料请求应发给Ricardo Mallarino。rmallarino@princeton.edu。作者贡献M.R.J.和R.M.构思了该项目并设计了实验。M.R.J. 进行了RNA-SEQ实验和大量RNA-Seq分析。 S.L. 在S.A.M.的帮助下,在条纹小鼠中进行了体外和体内基因组编辑。 和J.A.R.-P。 M.R.J. 和S.L. 对基因组编辑的动物进行了所有下游加工和分析。 下午和S.Y.S. 进行了数学建模。 C.F.G.-J. 在M.R.J.的支持下领导了SCRNA-SEQ分析。 和Q.N. M.R.J.,B.J.B. 和R.M. 进行原位杂交。 M.R.J.,B.J.B.,S.A.M。 和R.M. 进行了条纹小鼠和实验室小鼠组织的表型表征,包括免疫荧光和组织学。 M.R.J. 和S.A.M. 进行了黑素细胞细胞培养实验。 J.A.M. 进行了进化分析。 C.Y.F. 产生了横纹肌的MUS基因组和抬高注释。 J.G. 和A.P. 生成了永生的横纹纤维细胞。 M.R.J. 和R.M. 用所有作者的输入写了手稿。M.R.J.进行了RNA-SEQ实验和大量RNA-Seq分析。S.L. 在S.A.M.的帮助下,在条纹小鼠中进行了体外和体内基因组编辑。 和J.A.R.-P。 M.R.J. 和S.L. 对基因组编辑的动物进行了所有下游加工和分析。 下午和S.Y.S. 进行了数学建模。 C.F.G.-J. 在M.R.J.的支持下领导了SCRNA-SEQ分析。 和Q.N. M.R.J.,B.J.B. 和R.M. 进行原位杂交。 M.R.J.,B.J.B.,S.A.M。 和R.M. 进行了条纹小鼠和实验室小鼠组织的表型表征,包括免疫荧光和组织学。 M.R.J. 和S.A.M. 进行了黑素细胞细胞培养实验。 J.A.M. 进行了进化分析。 C.Y.F. 产生了横纹肌的MUS基因组和抬高注释。 J.G. 和A.P. 生成了永生的横纹纤维细胞。 M.R.J. 和R.M. 用所有作者的输入写了手稿。S.L.在S.A.M.的帮助下,在条纹小鼠中进行了体外和体内基因组编辑。和J.A.R.-P。 M.R.J.和S.L.对基因组编辑的动物进行了所有下游加工和分析。下午和S.Y.S. 进行了数学建模。 C.F.G.-J. 在M.R.J.的支持下领导了SCRNA-SEQ分析。 和Q.N. M.R.J.,B.J.B. 和R.M. 进行原位杂交。 M.R.J.,B.J.B.,S.A.M。 和R.M. 进行了条纹小鼠和实验室小鼠组织的表型表征,包括免疫荧光和组织学。 M.R.J. 和S.A.M. 进行了黑素细胞细胞培养实验。 J.A.M. 进行了进化分析。 C.Y.F. 产生了横纹肌的MUS基因组和抬高注释。 J.G. 和A.P. 生成了永生的横纹纤维细胞。 M.R.J. 和R.M. 用所有作者的输入写了手稿。下午和S.Y.S.进行了数学建模。C.F.G.-J. 在M.R.J.的支持下领导了SCRNA-SEQ分析。 和Q.N. M.R.J.,B.J.B. 和R.M. 进行原位杂交。 M.R.J.,B.J.B.,S.A.M。 和R.M. 进行了条纹小鼠和实验室小鼠组织的表型表征,包括免疫荧光和组织学。 M.R.J. 和S.A.M. 进行了黑素细胞细胞培养实验。 J.A.M. 进行了进化分析。 C.Y.F. 产生了横纹肌的MUS基因组和抬高注释。 J.G. 和A.P. 生成了永生的横纹纤维细胞。 M.R.J. 和R.M. 用所有作者的输入写了手稿。C.F.G.-J.在M.R.J.的支持下领导了SCRNA-SEQ分析。和Q.N.M.R.J.,B.J.B. 和R.M. 进行原位杂交。 M.R.J.,B.J.B.,S.A.M。 和R.M. 进行了条纹小鼠和实验室小鼠组织的表型表征,包括免疫荧光和组织学。 M.R.J. 和S.A.M. 进行了黑素细胞细胞培养实验。 J.A.M. 进行了进化分析。 C.Y.F. 产生了横纹肌的MUS基因组和抬高注释。 J.G. 和A.P. 生成了永生的横纹纤维细胞。 M.R.J. 和R.M. 用所有作者的输入写了手稿。M.R.J.,B.J.B.和R.M.进行原位杂交。M.R.J.,B.J.B.,S.A.M。 和R.M. 进行了条纹小鼠和实验室小鼠组织的表型表征,包括免疫荧光和组织学。 M.R.J. 和S.A.M. 进行了黑素细胞细胞培养实验。 J.A.M. 进行了进化分析。 C.Y.F. 产生了横纹肌的MUS基因组和抬高注释。 J.G. 和A.P. 生成了永生的横纹纤维细胞。 M.R.J. 和R.M. 用所有作者的输入写了手稿。M.R.J.,B.J.B.,S.A.M。和R.M.进行了条纹小鼠和实验室小鼠组织的表型表征,包括免疫荧光和组织学。M.R.J. 和S.A.M. 进行了黑素细胞细胞培养实验。 J.A.M. 进行了进化分析。 C.Y.F. 产生了横纹肌的MUS基因组和抬高注释。 J.G. 和A.P. 生成了永生的横纹纤维细胞。 M.R.J. 和R.M. 用所有作者的输入写了手稿。M.R.J.和S.A.M.进行了黑素细胞细胞培养实验。J.A.M. 进行了进化分析。 C.Y.F. 产生了横纹肌的MUS基因组和抬高注释。 J.G. 和A.P. 生成了永生的横纹纤维细胞。 M.R.J. 和R.M. 用所有作者的输入写了手稿。J.A.M.进行了进化分析。C.Y.F. 产生了横纹肌的MUS基因组和抬高注释。 J.G. 和A.P. 生成了永生的横纹纤维细胞。 M.R.J. 和R.M. 用所有作者的输入写了手稿。C.Y.F.产生了横纹肌的MUS基因组和抬高注释。J.G. 和A.P. 生成了永生的横纹纤维细胞。 M.R.J. 和R.M. 用所有作者的输入写了手稿。J.G.和A.P.生成了永生的横纹纤维细胞。M.R.J. 和R.M. 用所有作者的输入写了手稿。M.R.J.和R.M.用所有作者的输入写了手稿。
tenascin- c-介导的细胞外基质抑制...
抽象目标本研究的目的是确定Tenascin-C(TNC)在肠新骨形成中的作用,并探索潜在的分子机制。方法是从手术期间从强硬性脊柱炎(AS)的患者那里获得的韧带组织样品。建立了胶原蛋白抗体诱导的关节炎和DBA/1模型,以观察诱发的新骨形成。TNC表达。在动物模型中进行了TNC的全身抑制作用或遗传消融。通过原子力显微镜测量细胞外基质(ECM)的机械性能。通过RNA测序分析TNC的下游途径,并在体外和体内通过药理学调节确认。通过单细胞RNA测序(SCRNA-SEQ)分析TNC的细胞来源,并通过免疫荧光染色确认。结果在韧带和动物模型患者的诱发组织中异常上调TNC。TNC抑制作用显着抑制了诱发新骨形成。 功能分析表明,TNC通过增强内软骨骨化过程中的软骨分化来促进新的骨形成。 机械上,TNC抑制了ECM的粘附力,从而激活了下游河马/与YES相关的蛋白质信号传导,进而增加了软骨基因的表达。 SCRNA-SEQ和免疫荧光染色进一步表明,TNC主要由成纤维细胞特异性蛋白-1(FSP1)+成纤维细胞分泌。TNC抑制作用显着抑制了诱发新骨形成。功能分析表明,TNC通过增强内软骨骨化过程中的软骨分化来促进新的骨形成。机械上,TNC抑制了ECM的粘附力,从而激活了下游河马/与YES相关的蛋白质信号传导,进而增加了软骨基因的表达。SCRNA-SEQ和免疫荧光染色进一步表明,TNC主要由成纤维细胞特异性蛋白-1(FSP1)+成纤维细胞分泌。结论炎症引起的FSP1+成纤维细胞对TNC的异常表达,通过抑制ECM粘附力并激活HIPPO信号传导来促进肠新骨形成。
滋养细胞干细胞论坛议程
这项研究探讨了人类滋养细胞干细胞(HTSC)作为间充质组织再生的新细胞来源的潜力。使用RNA测序和免疫荧光染色,发现与口面衍生的间充质干细胞(MSC)相比,发现表现出优越的增殖和成骨功能。未来的研究将进一步研究组织再生,免疫调节和体内疾病治疗的应用。
sancao汤剂与顺铂结合减轻乳腺癌的肺转移,可缓解前转移性壁niche
摘要背景:中医化合物Sancao汤(SCD)是调节免疫力的民间处方。它由8种中草药,例如Prunellae Spica(Xiakucao),Houttuyniae Herba(Yuxingcao),Lysimimachiae Herba(Jinqiancao)等。在癌症中,白介素-6(IL-6)/转录3(STAT3)途径的信号传感器和激活因素直接促进癌细胞的增殖,存活和血管生成,精氨酸酶-1(ARG-1)是骨髓机源性抑制细胞(MDSCS)的关键酶,以促进免疫功能。尚不清楚SCD是否通过IL-6/STAT3途径调节MDSC中ARG-1的表达。因此,我们探讨了SCD对乳腺癌肺转移的作用和机制。方法:SCD中的组件已通过HPLC-MS分析。通过将4T1细胞注入BALB/C小鼠的乳腺脂肪垫中,建立了乳腺癌的自发转移模型。通过肺转移结节,肺病理学测试和免疫荧光评估2-4周,评估了 te-div>用肺转移结节,肺病理测试和免疫荧光评估SCD对PMN的作用。 血清测试和苏木精 - 欧洲蛋白染色(H&E)用于评估顺铂的副作用。 Western印迹和ELISA用于检测小鼠肺组织中Stat3信号通路的蛋白质和细胞因子。 结果:与仅SCD或顺铂治疗相比,SCD/顺铂(CP)协同给药不仅显着抑制了正交性乳腺肿瘤的生长,而且还减少了肺转移,并减少了CP诱导的肝毒性。te-div>用肺转移结节,肺病理测试和免疫荧光评估SCD对PMN的作用。血清测试和苏木精 - 欧洲蛋白染色(H&E)用于评估顺铂的副作用。Western印迹和ELISA用于检测小鼠肺组织中Stat3信号通路的蛋白质和细胞因子。结果:与仅SCD或顺铂治疗相比,SCD/顺铂(CP)协同给药不仅显着抑制了正交性乳腺肿瘤的生长,而且还减少了肺转移,并减少了CP诱导的肝毒性。值得注意的是,该组合有效地抑制了PMN的形成和MDSC在肺PMN中的积累,并伴随着CD4
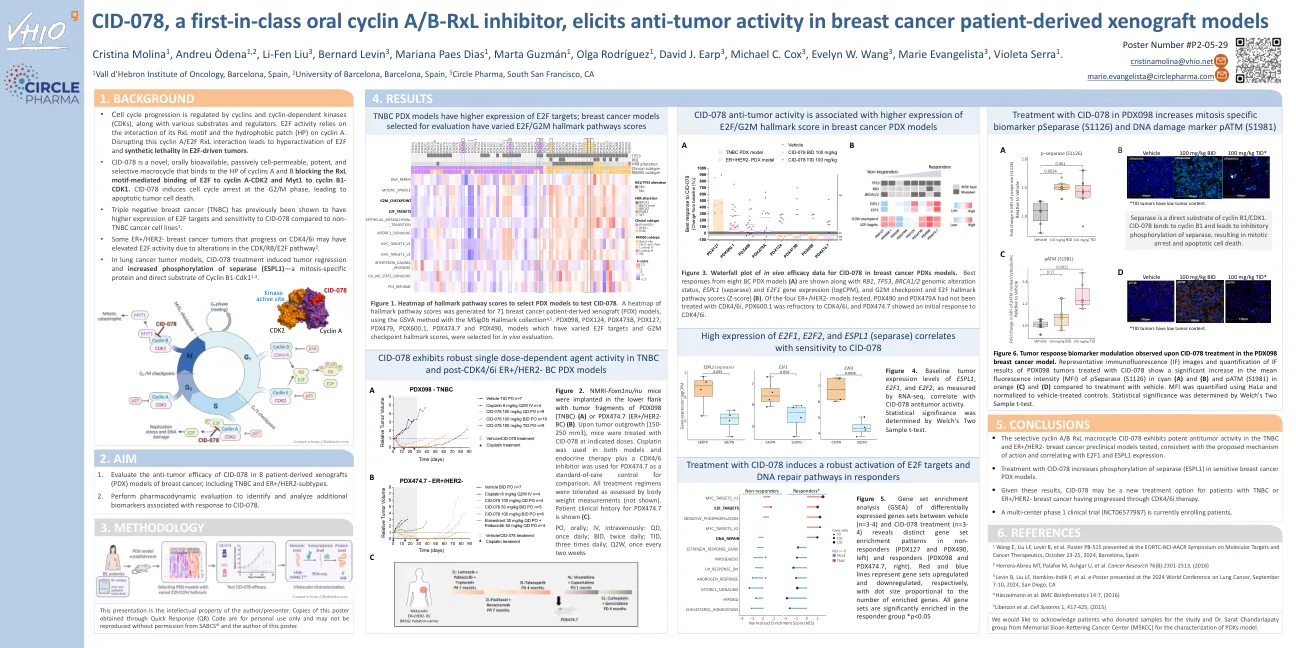
CID-078 是一种首创的口服细胞周期蛋白 A/B-RxL 抑制剂,可在乳腺癌患者异种移植模型中引发抗肿瘤活性
图 6. 在 PDX098 乳腺癌模型中,CID-078 治疗后观察到的肿瘤反应生物标志物调节。用 CID-078 治疗的 PDX098 肿瘤的代表性免疫荧光 (IF) 图像和 IF 结果的量化显示,与使用载体治疗相比,pSeparase (S1126)(青色)(A)和(B)以及 pATM (S1981)(橙色)(C)和(D)的平均荧光强度 (MFI) 显著增加。使用 HaLo 量化 MFI 并归一化为载体治疗的对照。通过 Welch 的双样本 t 检验确定统计显着性。
图S8:RAB10定位的确定
要检查RAB10的定位是否在SMAD4损失的设置中发生变化,我们在SW620和HT29的SMAD4中存在或不存在的HT29同源细胞上进行了免疫荧光实验。将带有诱导质粒PSMAD4的SMAD4阴性细胞系HT29和SW620在第0天接种,在第1天用强力霉素处理72H。rab10(#ab237703 1:400)随后与早期(EEA1,#BD 610456 1:400)和迟到(CD63,#AB1318 1:400)共同染色。用Zeiss Axio观察者荧光显微镜拍摄的图片。
IDE161 是一种潜在的首创临床候选 PARG 抑制剂,选择性靶向具有复制压力和 DNA 修复脆弱性的实体肿瘤
A) 描绘了对 TOP1 和 PARG 双重抑制的拟议 MOA 的模型。B) 对 PRISM 化合物和 PARGi 的反应的 Spearman 相关图;橙色表示 TOP1 抑制剂,黑色表示其他。(插图)按 MOA 分组的顶级相关化合物的 Swarmplot(未显示少于 2 种化合物的 MOA)。拓扑异构酶抑制剂 (TOP)、法呢基转移酶 (FT)、微管蛋白聚合 (TP)、极光激酶 (AK)、胸苷酸合酶 (TS)。C) 使用 PAR MSD 测定法评估 PAR 链积累。值绘制为相对于 DMSO 对照的平均值 ± SD。使用 Student's t 检验进行统计分析;ns(不显著)、**(<0.01)、***(<0.001)。D)(左)使用基于抗 TOP1cc 抗体的免疫荧光测定法在指示时间点测量 TOP1-DNA 裂解复合物 (TOP1cc)。根据单个细胞中的 TOP1cc 平均强度值进行群体分箱和非线性曲线拟合。使用 Kruskal-Wallis 检验进行统计分析;****(<0.0001)。(右)使用基于抗 γ -H2AX 抗体的免疫荧光测定法检测核 γ -H2AX。值(平均值 ± SD)绘制为 γ -H2AX 平均强度范围的百分比群体。E)从 CldU 标记的 DNA 纤维测量结果显示,IDE161 和 CPT 介导的复制叉减慢。框表示中位数和 IQR。使用 Mann-Whitney U 检验进行统计分析;*(<0.05),**** (<0.0001)。