XiaoMi-AI文件搜索系统
World File Search System2019冠状病毒病疫苗
不是。大多数 COVID-19 疫苗都是由 mRNA 制成的。含有 mRNA 的疫苗会向您的细胞发出指令,这样您的免疫系统就知道如何保护您的身体免受 COVID-19 病毒的侵害。mRNA 会在数小时内分解并从您的系统中排出。虽然 mRNA 疫苗是新技术,但 mRNA 技术并非如此。多年来,医疗保健提供者一直使用它来治疗癌症和其他病毒性疾病。它不会以任何方式改变或影响您的 DNA。
2019冠状病毒病疫苗
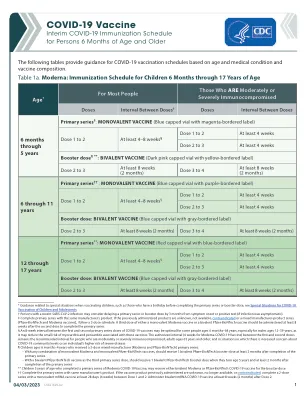
* 有关为儿童接种疫苗的特殊情况的指导,例如在完成基础疫苗系列或加强剂之前过生日的儿童,请参阅儿童和青少年 COVID-19 疫苗接种的特殊情况 † 近期感染 SARS-CoV-2 的人可考虑将基础疫苗系列或加强剂推迟至出现症状或检测呈阳性后 3 个月(如果感染无症状)。 ‡ 使用同一制造商的产品完成基础疫苗系列。如果之前接种的产品未知、不可用、有禁忌症或为混合制造商产品系列(辉瑞-BioNTech 和 Moderna 疫苗),请遵循 3 剂的时间表。第三剂单价 Moderna 疫苗或二价辉瑞-BioNTech 疫苗应在第二剂后至少 8 周接种,以完成基础疫苗系列。 § 对于某些 6 个月至 64 岁的人来说,COVID-19 疫苗第一剂和第二剂基础系列疫苗之间的 8 周间隔可能是最佳间隔,尤其是对于 12 至 39 岁的男性,因为这可能会降低与这些疫苗相关的心肌炎和心包炎的微小风险。第一剂和第二剂之间的授权间隔(Moderna COVID-19 疫苗为 4 周)仍然是以下人群的推荐间隔:中度或重度免疫功能低下的人;65 岁及以上的成年人;以及在人们更加担心社区 COVID-19 水平或个人患重症风险较高的情况下。¶ 接受了 3 剂混合制造商(Moderna 和 Pfizer-BioNTech)基础系列疫苗的 6 个月至 4 岁儿童:
2019冠状病毒病疫苗
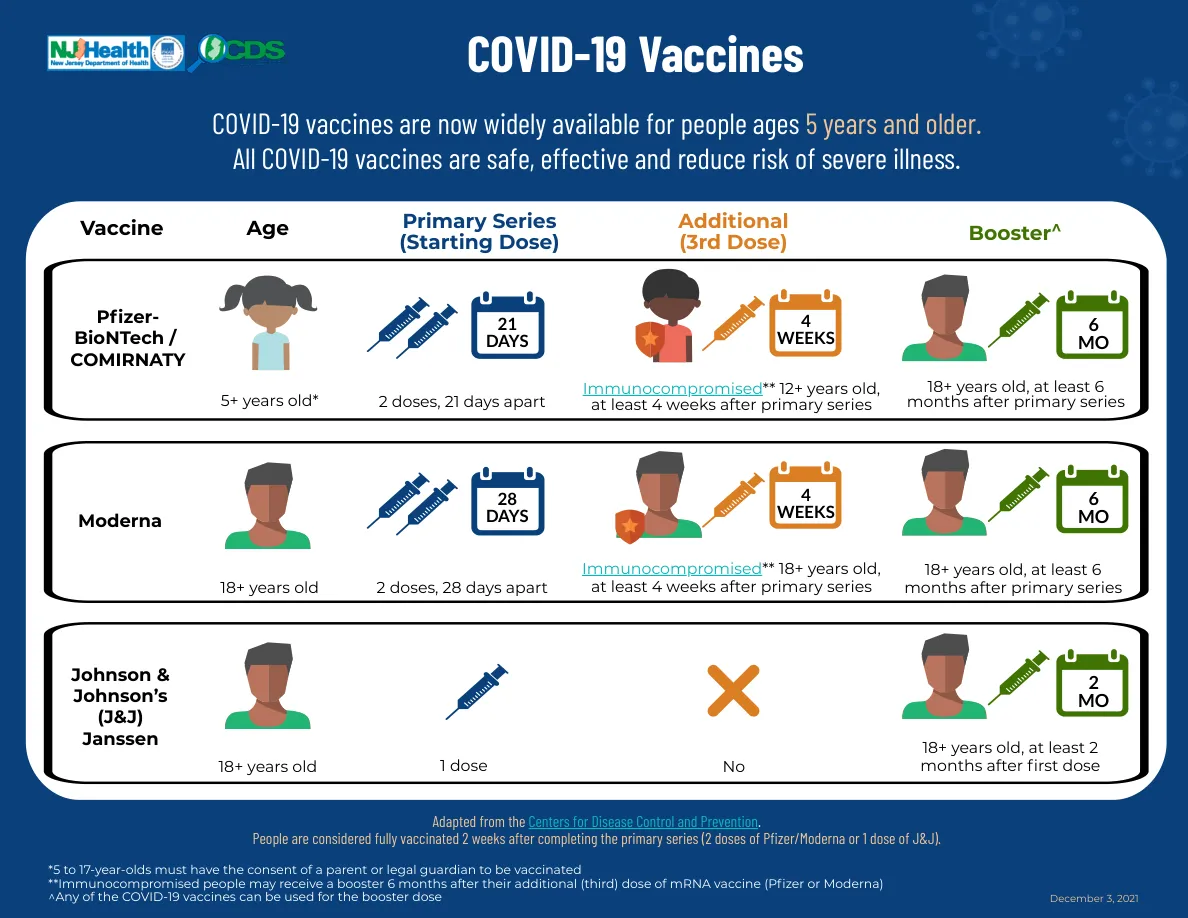
随着这种疫苗在未来几周到几个月内可供我们所有人使用,令人惊讶的是,COVID-19 将被视为一种可预防的疾病!!!!!基于对志愿者(我心目中的爱国者)进行的大量出色研究,这种疫苗已被证明是有效和安全的。在两次注射中的第一针后,对出现症状的 COVID-19 的保护率似乎约为 52-80%(取决于您接种哪种疫苗),在第二针注射后 7-14 天,保护率将跃升至约 95%。 让我再说一遍,因为感觉太好了,在第二针后,您感染症状性 COVID-19 的风险将降低 95%。 此外,根据试验,发展为严重 COVID-19 的风险似乎大幅降低,因为在 Moderna 试验中没有严重 COVID 病例,在辉瑞试验中只有一例(这是个好消息)。
2019冠状病毒病疫苗
*5 至 17 岁的青少年必须获得父母或法定监护人的同意才能接种疫苗 **免疫功能低下的人可以在接种额外(第三)剂 mRNA 疫苗(辉瑞或 Moderna)6 个月后接种加强剂 ^任何一种 COVID-19 疫苗都可用于加强剂
2019冠状病毒病疫苗
并且我了解 COVID-19 疫苗的益处和风险。 ➢ 我了解,此次疫苗接种的记录将输入缅因州免疫信息系统 ImmPact。 ➢ 我了解,建议我今天接种疫苗后至少在现场停留 15 分钟。 ➢ 我同意通过以下签名为上述人员接种 COVID-19 疫苗。
2019冠状病毒病疫苗
我们调整任何疫苗时的目标是使用适当的类别原因进行调整。离开库存的每种与患者没有明确关联的疫苗都应该有一个非常明确且可解释的原因。例如:如果您知道您掉落并摔坏了一个药瓶,或者剂量确实过期了,您可以使用适当的类别和原因对其进行调整。但是,如果数字不匹配而您又找不到它,则在联系该计划之前,您不应对其进行核对。这些剂量必须得到说明。
人类冠状病毒的鉴定
王哲 1,* Amit Nautiyal,2 黄晓舟,3 何睿 3 董沛 3,* 摘要 近期爆发的呼吸道疾病(由新型冠状病毒 SARS-CoV-2 引起的 COVID-19)是当前大流行的罪魁祸首,对公共健康造成了巨大风险。快速准确的识别方法是预防这种大流行的关键,有助于选择合适的治疗方法并挽救人们的生命。聚合酶链反应(PCR)被认为是这些感染的金标准测试诊断,具有高灵敏度和特异性。它是第一个核酸扩增方法。随着研究的进步,已经开发出许多其他核酸扩增方法,例如环介导等温扩增、基于核酸序列的扩增、链置换扩增和滚动循环扩增等。这些等温核酸扩增方法被认为是很有前途的方法,因为它在恒温下的操作时间很快,因此无需使用热循环仪。本综述总结了可用于准确检测的各种现有的、改进的、新开发的和替代的方法/方法,以帮助研究人员和临床医生开发更好的方法,及时有效地检测冠状病毒。