XiaoMi-AI文件搜索系统
World File Search System评估基因型NTM-DR分析性能,用于鉴定和分子检测脓肿的分枝杆菌复合物
1 Laboratory of Bacte´riology, Center Hospitalier Universitaire de Montpellier, Montpellier, France, 2 Mivegec, IRD, CNRS, Universite´ de Montpellier, Montpellier, France, 3 Bordeaux Population Health Center U1219, Universite´ de Bordeaux, Bordeaux, France, 4 CYSTIC FIBROSIS Center, University Hospital of Montpellier,细菌学院卫生部,南特斯大学,南特斯大学,法国南特大学,6 Unirouen,Gram EA2656,Rouen University Hospital,Normandy Universite´,Rouen,Rouen,France,7 USC EA 3671 Mycoplasmes和Chlamydiae的人类感染。 Bordeaux,Borteaux,Bortaux,法国,8 Chu de Toulouse,Bacte´riology-hygiè,Institut fe´dératif de Biologie,图卢兹,图卢兹,法国9个细菌疗法 - 医院卫生系,布雷斯特大学,布雷斯特大学,布雷斯特大学,布雷斯特,布雷斯特,10个实验室,苏尔,sn ofero sn sn oilo sn sn ofer sn Dioulasso,布基纳法索(Brkina Faso),东南亚的11 LMI耐药性“ Drisa”,IRD Montpellier,Montpellier,法国,1 Laboratory of Bacte´riology, Center Hospitalier Universitaire de Montpellier, Montpellier, France, 2 Mivegec, IRD, CNRS, Universite´ de Montpellier, Montpellier, France, 3 Bordeaux Population Health Center U1219, Universite´ de Bordeaux, Bordeaux, France, 4 CYSTIC FIBROSIS Center, University Hospital of Montpellier,细菌学院卫生部,南特斯大学,南特斯大学,法国南特大学,6 Unirouen,Gram EA2656,Rouen University Hospital,Normandy Universite´,Rouen,Rouen,France,7 USC EA 3671 Mycoplasmes和Chlamydiae的人类感染。Bordeaux,Borteaux,Bortaux,法国,8 Chu de Toulouse,Bacte´riology-hygiè,Institut fe´dératif de Biologie,图卢兹,图卢兹,法国9个细菌疗法 - 医院卫生系,布雷斯特大学,布雷斯特大学,布雷斯特大学,布雷斯特,布雷斯特,10个实验室,苏尔,sn ofero sn sn oilo sn sn ofer sn Dioulasso,布基纳法索(Brkina Faso),东南亚的11 LMI耐药性“ Drisa”,IRD Montpellier,Montpellier,法国,Bordeaux,Borteaux,Bortaux,法国,8 Chu de Toulouse,Bacte´riology-hygiè,Institut fe´dératif de Biologie,图卢兹,图卢兹,法国9个细菌疗法 - 医院卫生系,布雷斯特大学,布雷斯特大学,布雷斯特大学,布雷斯特,布雷斯特,10个实验室,苏尔,sn ofero sn sn oilo sn sn ofer sn Dioulasso,布基纳法索(Brkina Faso),东南亚的11 LMI耐药性“ Drisa”,IRD Montpellier,Montpellier,法国,
新用途中的DNA微阵列芯片分析:皮肤分枝杆菌感染的早期诊断价值
结果:从2019年到2021年,检测到皮肤分枝杆菌感染的发病率增加。最常见的感染病原体是野马菌,然后是脓肿。皮肤组织培养方法的敏感性,特异性和准确性分别为70%,100%和76.62%,而DNA微阵列CHIP测定法分别为91.67%,100%和93.51%。DNA微阵列芯片测定的灵敏度和准确性显着高于皮肤组织培养方法的灵敏度和准确性。这两种方法的阳性可能性和诊断优势比分别> 10和> 1。与DNA微阵列CHIP分析相比,皮肤培养方法中的负类似然比显着高(30%比8.33%),而Youden的指数显着较低(70.00%vs 91.67%)。假阴性结果与皮肤组织培养方法中使用抗生素的史存在显着关联。
静脉注射乳杆菌的静脉注射乳杆菌疫苗接种后,针对结核分枝杆菌的防护相关性
(未通过同行评审认证)是作者/资助者。保留所有权利。未经许可就不允许重复使用。此预印本版的版权持有人于2023年8月2日发布。 https://doi.org/10.1101/2023.07.31.551245 doi:biorxiv preprint
使用有针对性的纳米孔测序快速诊断出海洋分枝杆菌感染:病例报告
海藻分枝杆菌(M. Marinum)是一种无结核分枝杆菌(NTM),可以在水生动物和人类中引起感染性疾病。基于培养的病原体检测是诊断NTM感染的金标准。但是,这种方法是耗时的,对于挑剔的生物来说,阳性率低。牛津纳米孔奴才测序是一种新兴的第三代测序技术,可以直接以培养的方式序列DNA或RNA,并提供快速的微生物识别。进一步的好处包括低成本,短时间的时间,读取长度和小设备尺寸。纳米孔测序在评估耐药性,微生物的临床鉴定和监测感染性疾病方面起着至关重要的作用。使用纳米孔测序的一些关于结核分枝杆菌(MTB)的报告已发表,但是,关于NTM的报告很少,例如M. Marinum。在这里,我们报告了使用纳米孔测序诊断纳米孔测序。
社论:肠肺轴:结核病和耐药性
肠道菌群由消化道中的微生物组成,在维持整体健康方面发挥着关键作用。研究人员发现该生态系统与不同器官和系统之间存在联系,影响免疫、代谢和功能。在这些联系中,肠肺轴是一个复杂的区域,有可能改变结核病 (TB) 和耐药性的治疗。此外,肠道菌群会影响结核病药物的代谢。结核分枝杆菌感染是一个全球性的健康问题,需要有效的控制措施,而对人类微生物群的研究起着至关重要的作用 (Wu et al., 2023)。了解肠道菌群、免疫系统和药物代谢之间的相互关系可以导致针对性治疗,解决结核病感染和耐药性的根本问题。微生物群组成的不平衡是结核分枝杆菌发病机制和药物代谢的重要因素。然而,很少有研究探讨结核分枝杆菌感染如何与肠肺轴微生物群组成相互作用。本研究主题旨在揭示这种联系,强调肠肺轴和耐药性在结核病管理策略中的重要性。重点是结核分枝杆菌,但也包括对其他分枝杆菌科菌株的研究。在这个研究主题中,已经发表了五篇文章,扩大了我们对肠肺轴在结核病感染和耐药性中的作用的理解。
重新探索水杨酰基支架,以抑制结核分枝杆菌中的霉菌酸合成
全球结核病报告2023。(世界卫生组织,日内瓦,2023年); Butler,M。S。等。对具有新作用模式的抗菌候选者的审查。ACS感染。dis。10,3440–3474(2024); Gavalda,S。等。PKS13/FADD32串扰结核分枝杆菌中霉菌酸的生物合成。生物学杂志284,19255–19264(2009); Galandrin,S。等。用于鉴定分枝杆菌FADD32活性抑制剂的测定开发。SLAS Discovery 18,576–587(2013); Le,N.-H。等。针对分枝杆菌脂肪酰基 - A酰基 - AM-AMP连接酶FAAL32的药物筛查方法更新了Salicylanilide药物团在抗结结核病中的兴趣。生物有机和药物化学71,116938(2022)。
乙曲硼罗对小鼠肺部感染模型中脓肿分枝杆菌的疗效
摘要 脓肿分枝杆菌 (Mab 或 Mycobacterium abscessus) 是一种快速生长的分枝杆菌,在环境中普遍存在,可导致患有肺部合并症和免疫缺陷的人发生机会性疾病。目前尚无美国食品药品监督管理局批准的治疗这种疾病的药物,而重新利用的抗生素的微生物学反应不佳。为了满足对有效新型抗生素的需求,我们在小鼠肺部 Mab 感染模型中确定了 Epetraborole (EBO) 对三种 Mab 临床分离株的疗效。4 周治疗期间肺部 Mab 负担的减少是研究的终点。EBO 以 25 和 50 mg/kg 的剂量每日口服一次,在人类中达到的暴露量分别接近每日一次的 250 mg 和 500 mg 的剂量。EBO 给药导致肺部 Mab 负担逐渐减少。经过 4 周的治疗,25 和 50 mg/kg EBO 对分离株 ATCC 19977 和 M9501 的疗效相当。然而,对分离株 M9530,50 mg/kg EBO 比 25 mg/kg 更有效,且与肠外注射亚胺培南相当,亚胺培南是抗 Mab 最有效的抗生素之一。我们还进行了一项剂量范围研究,评估了 4 周内每日一次口服 0.5、5、10、25 和 100 mg/kg EBO 对 M9501 的疗效。每日一次口服 100 mg/kg EBO 与每日两次注射 100 mg/kg 亚胺培南一样有效。我们的研究表明,鉴于 Mab 药物耐药率高且可耐受的静脉注射选择有限,EBO 可以满足 Mab 肺病对有效口服治疗选择的未满足需求。
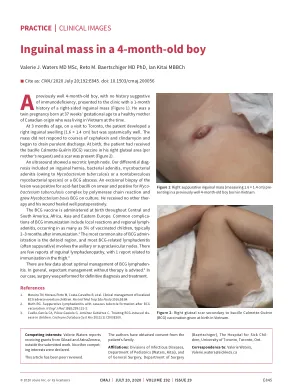
4 个月大男孩腹股沟肿块
一名既往健康的 4 个月大男孩,没有免疫缺陷病史,因右侧腹股沟肿块 1 个月来就诊(图 1)。他是双胞胎,胎龄 37 周出生,母亲是健康的加拿大裔,当时居住在越南。3 个月大时,患者在多伦多就诊时出现右侧腹股沟肿块(1.6 × 1.4 厘米),但全身健康。头孢氨苄和克林霉素治疗对肿块无反应,并开始流出脓性分泌物。出生时,患者右臀部接种了卡介苗 (BCG) 疫苗(根据母亲的要求),并且出现疤痕(图 2)。超声检查显示淋巴结坏死。我们的鉴别诊断包括腹股沟疝、细菌性淋巴结炎、分枝杆菌淋巴结炎(由结核分枝杆菌或非结核分枝杆菌引起)或 BCG 脓肿。病变切除活检涂片呈抗酸杆菌阳性,聚合酶链反应呈结核分枝杆菌复合体阳性,培养呈牛分枝杆菌 BCG 生长。患者未接受其他治疗,术后伤口愈合良好。中南美洲、非洲、亚洲和东欧地区出生时均接种 BCG 疫苗。BCG 免疫接种的常见并发症包括局部反应和区域性淋巴结炎,多达 5% 的接种儿童会出现这些并发症,通常在免疫接种后 2-3 个月发生。 1 BCG 最常见的注射部位是三角肌区域,大多数 BCG 相关淋巴结炎(通常为化脓性)涉及腋窝淋巴结或锁骨上淋巴结。腹股沟淋巴结肿大的报道很少,其中 1 例与大腿免疫接种有关。2
信息表:GenoScreen Deeplex Myc-TB 测试
GenoScreen 拥有基于新一代测序 (NGS) 的试剂盒,可同时识别分枝杆菌种类、进行基因分型并预测结核分枝杆菌复合群 (MTBC) 菌株的耐药性;该试剂盒 (Deeplex® Myc-TB) 可直接用于临床样本 (1) 。该检测依赖于单个 24 重扩增子混合物的深度测序,针对与一线和二线抗结核药物(利福平、异烟肼、吡嗪酰胺、乙胺丁醇、氟喹诺酮类、阿米卡星、卡那霉素、卷曲霉素、链霉素、乙硫异烟胺、贝达喹啉、氯法齐明和利奈唑胺)耐药性相关的 18 个主要 MTBC 基因区域。 hsp65 基因是分枝杆菌种属识别的靶标,而 spoligotyping 靶标(CRISPR/直接重复 [DR] 基因座)和耐药相关靶标中的系统发育单核苷酸多态性 (SNP) 用于 MTBC 菌株基因分型。
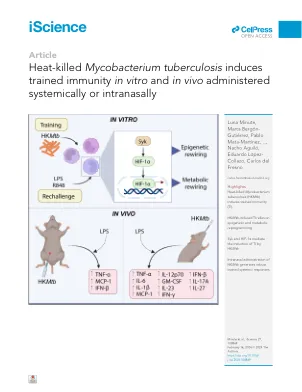
热杀死的结核分枝杆菌诱导受过训练的免疫力Invitro和Invivo在全身或室内施用
摘要训练的免疫(TI)代表了先天免疫细胞的记忆样过程。ti可以用各种化合物(例如真菌B-葡聚糖或结核病疫苗)启动。从未考虑到利用TI防止感染和癌症的临床应用,对新的,简单且易于使用的TI诱导剂的需求日益增长。在这里,我们证明了热杀死的细菌结核(HK MTB)在体外和体内诱导Ti。在人类的单核细胞中,这种效果代表了一个真正受过训练的过程,因为HK MTB赋予针对各种异源挑战的炎症反应,例如脂多糖(Toll-like受体[TLR] 4 Ligand)和R848(TLR7/8 Ligand)(TLR7/8 Ligand)。从机械上讲,HK MTB诱导的Ti依赖于SYK/HIF -1 A依赖性方式的表观遗传机制。在体内,HK MTB在系统地和室内施用时会诱导Ti,而后者产生更健壮的Ti响应。总而言之,我们的研究表明,香港MTB有可能充当粘膜免疫疗法,可以成功诱导训练有素的反应。