XiaoMi-AI文件搜索系统
World File Search System2024 年 11 月 14 日 081-68W-0401 操作流体加温器状态
条件:在临床或操作环境中,您已收到医疗命令,通过静脉输液提供加热静脉 (IV) 溶液、血液或血液制品。所有其他直接生命威胁都已得到治疗和处理。您已经进行了患者护理洗手并进行了身体物质隔离。您将获得患者的临床记录、血液液体加温系统、IV 溶液、血液或血液制品、酒精垫、胶带、笔和国防部表格 1380(战术战斗伤亡护理 (TCCC) 卡)、标准表格 (SF) 510(护理记录)(如果有)或 SF 600 医疗记录-医疗护理的时间记录或电子医疗记录 (EMR)。此任务不应在 MOPP 4 中进行培训。标准:按照 (IAW) 制造操作程序、战术战斗伤亡护理 (TCCC) 指南操作液体加热器;由联合创伤系统 (JTS) 战术战斗伤员救治委员会 (CoTCCC) 进行,同时遵守所有警告和注意事项,使用任务通过/不通过清单准确无误。特殊条件:在训练此任务时,领导者应结合使用陆军条令的八个相互关联的作战变量的情景/情况:政治;军事;经济;社会;信息;基础设施;物理环境,时间,(PMESII-PT),以教育士兵了解作战环境 (OE) 意识,强化价值观,并解决当前的陆军问题,以完善士兵对陆军作战的理解。几乎每场冲突中都会出现 PMESII-PT 变量,它们是 OE 的基石。它们可以相互关联、重叠,并共同作为理解 OE 的基础。安全风险:低 MOPP 4:从不
致市长和市议会的备忘录——增加温哥华气候智能型可再生能源供应
- 温哥华目前有 338 个 BC Hydro 净计量项目(主要是太阳能)。 - 2023 年 9 月批准多路复用后,RS 区域的各种设计指南将被取消,预计将使有意在新的 R1-1 区域安装太阳能电池板的居民更加容易。这一标准化将补充早期为简化和简化太阳能许可流程所做的努力。 - 该市的社区能源公用事业公司利用从污水中捕获的能量为超过 640 万平方英尺的住宅、商业和机构空间提供空间供暖和热水。随着时间的推移,可以添加其他本地可再生能源,以支持系统扩展并实现向 100% 可再生能源的过渡。 - 工作人员还支持开发和脱碳当地非市属区域能源系统,重点是实现废热能回收和扩大可再生能源的影响(例如,River District 和 Sen̓ áḵw)。
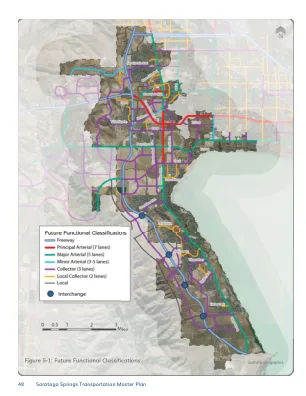
萨拉托加温泉市战略市中心总体规划 2022
目录 第一部分 简介 1.1 关于城市 1.2 意图 1.3 所需公司服务 1.4 当前计划 第二部分 所需公司信息 2.1 提交材料 2.2 公司信息 2.3 公司能力 2.4 财务和法律信息 2.5 保险和赔偿 2.6 经验 2.7 定价 2.8 提交提案 第三部分 评估 3.1 评估标准 3.2 提案格式 3.3 特殊考虑 3.4 评估标准 - 叙述 第四部分 附加条款 4.1 公司关键人员 4.2 谈判 4.3 利益冲突 4.4 限制性讨论 4.5 奖励 4.6 标准保险要求 第五部分 提案文件和封面指南 5.1 提案人认证表 5.2 萨拉托加斯普林斯市提案表 5.3 赔偿和免责协议表 5.4利益冲突披露表 5.5 保险要求附件
P-2030-S 毛毯加温柜手册 - Universal Medical
单隔间加温柜由 22 号不锈钢外壳和门构成,手柄和铰链设计用于承受高强度使用。柜子由 Halo Heat® 系统加热,该系统包含安装在隔间壁上的低瓦特密度电缆。该系统提供均匀分布的热量,无需热循环风扇。柜子由可调节的电子恒温器控制,其中包括热量指示灯 LED、温度设置按钮、温度升高和降低按钮以及用于监控隔间温度的数字显示屏。恒温器的温度范围为最低 90°F (32°C) 至最高 200°F (93°C)。该室配备一 (1) 个带搁板的白色环氧涂层毯式支撑组件,并配有一 (1) 套 5 英寸 (127 毫米) 重型脚轮 — 两个刚性脚轮和两个带刹车的旋转脚轮。