XiaoMi-AI文件搜索系统
World File Search System胰脏癌治疗新境界
尽管精确医学取得了迅速的进展,但治疗胰腺癌几乎没有突破。实际上,我们获得了有关胰腺癌的遗传学和转录组学的更多信息,但是没有针对常见遗传改变的药物,包括KRAS,TP53,CDKN2A和SMAS4。在先前的研究中,在12-25%的患者中鉴定出了可能可行的改变。在知道您的肿瘤登记试验中,在接受靶向疗法的患者中观察到总体存活率明显更长。同源重组修复(HR)缺乏症(HRD)在少数胰腺癌患者中鉴定出来。种系BRCA1/2和种系PALB2被认为是核心人力资源基因,在未选择的胰腺癌病例中有5-6%被鉴定出来。在患有GBRCA1/2突变的患者中,通过基于铂的治疗记录了出色的反应。在2019年,PARPI的Olaparib被批准为GBRCA1/2突变晚期/转移性胰腺癌的患者,作为维持疗法。不匹配修复(MMR)缺陷(MMRD)是pembrolizumab的众所周知的肿瘤生物标志物,可以预测免疫检查点抑制剂。尽管有多项潜在靶疗法的临床试验失败,但仍在进行了几项临床试验。我们希望我们可以采用个性化治疗策略来治疗每个患者,以优化临床结果并改善未来患者的生活质量。
NCCN Guidelines 版本2.2024 成人癌痛
*Robert A. Swarm,医学博士/主席Barnes-犹太医院和华盛顿大学医学院的现场癌症中心 *Jeanie M. Youngwerth,医学博士/副主席/副主席£科罗拉多州癌症中心Julia L. Agne,MD£程度综合癌症中心Madhuri是MD£Fred&Pamela Buffett癌症中心Sorin Buga,医学博士,希望市政府国家医疗中心Marcin Chwistek,MD£fox Chase Cancer Center Centar Cencer Center James James james Cleary,M.Dindiana University Melvin和Bren Simon Simon Simon Simon综合癌症中心,MD圣地亚哥摩尔癌中心戴维·克雷格(David Craig)
无辅料“糖衣炮弹”靶向治疗原位肝细胞癌
纳米医学为改善传统化疗的临床结果提供了一个有希望的机会,传统化疗通常存在水溶性差、肿瘤靶向能力低和血液/肾脏清除速度快的缺点。1 – 3 一些纳米制剂,包括脂质体、4 – 7 聚合物、8 – 11 和无机材料 12 – 14,具有增强渗透性和保留 (EPR) 效应,在实验室中比游离分子药物表现出更高的功效。然而,很少有抗癌纳米药物获得美国食品药品监督管理局 (FDA) 批准。15 – 17 最明显的局限性之一是这些纳米制剂通常需要多种成分,这导致结构异质性、重现性差和赋形剂引发的生物毒性,这些都是限制临床转化的重要障碍。 18 – 20 另一个限制是,尽管抗肿瘤药物在纳米载体的帮助下被运送到肿瘤,但它们在肿瘤病灶中的保留率很低。 21 – 23 分子药物由癌细胞中的 e ffl 通量蛋白泵出,导致
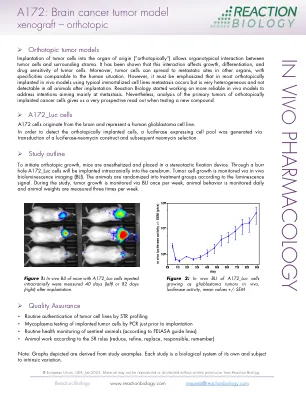
A172:脑癌肿瘤模型 - 异种移植 - 原位
将肿瘤细胞植入起源器官(“原始方面”)允许肿瘤细胞与周围基质之间的器官相互作用。已经表明,这种相互作用会影响肿瘤细胞的生长,分化和药物敏感性。此外,肿瘤细胞可以扩散到其他器官中的转移性位点,具有与人类情况相当的特异性。但是,必须强调的是,在大多数原始植入的体内模型中,使用典型的永生细胞系转移发生,但在植入后所有动物中都非常异构,在所有动物中都无法检测到。反应生物学开始研究更可靠的体内模型,以解决主要针对转移的意图。然而,对原位植入癌细胞的原发性肿瘤的分析使我们在测试新化合物时读出了非常前瞻性的。
临床前癌研究中的原位和转移性肿瘤模型
约翰·范·吉斯特(John van Geest for for Cambridge)剑桥干细胞研究所,约翰·范·盖斯(John van Geest)大脑维修中心,英国剑桥大学,英国剑桥大学B UCL B UCL呼吸科,英国伦敦大学伦敦大学,英国C C C c c c c c c c c C c C c C c C c C c c in Nottingham,Intingham,Inkeration,UK Degenland,Ink degenland,degenland in notting Hiodisvery Institute of Nottingham Biodiscovery Institute of Nottingham Biodiscovery研究所波特贝洛,波多贝洛,英国,英国E E e化学工程学院,医疗保健技术研究所,翻译医学研究所伯明翰大学,伯明翰,英国,英国,英国,再生医学中心,再生和维修研究所,爱丁堡大学,爱丁堡大学,爱丁堡大学,爱丁堡生物群,小法国班级,comcotland,compland comcomply comcomply commotice commotication of Cambridge, and NHS Blood and Transplant, England, UK h Bone & Joint Research Group, Centre for Human Development, Stem Cells & Regeneration, Faculty of Medicine, University of Southampton, Southampton, England, UK i Department of Materials, Department of Bioengineering, and Institute of Biomedical Engineering, Imperial College London, London, England, UK j School of Bioscience, The University of Sheffield, Western Bank, Sheffield, England,英国约翰·范·吉斯特(John van Geest for for Cambridge)剑桥干细胞研究所,约翰·范·盖斯(John van Geest)大脑维修中心,英国剑桥大学,英国剑桥大学B UCL B UCL呼吸科,英国伦敦大学伦敦大学,英国C C C c c c c c c c c C c C c C c C c C c c in Nottingham,Intingham,Inkeration,UK Degenland,Ink degenland,degenland in notting Hiodisvery Institute of Nottingham Biodiscovery Institute of Nottingham Biodiscovery研究所波特贝洛,波多贝洛,英国,英国E E e化学工程学院,医疗保健技术研究所,翻译医学研究所伯明翰大学,伯明翰,英国,英国,英国,再生医学中心,再生和维修研究所,爱丁堡大学,爱丁堡大学,爱丁堡大学,爱丁堡生物群,小法国班级,comcotland,compland comcomply comcomply commotice commotication of Cambridge, and NHS Blood and Transplant, England, UK h Bone & Joint Research Group, Centre for Human Development, Stem Cells & Regeneration, Faculty of Medicine, University of Southampton, Southampton, England, UK i Department of Materials, Department of Bioengineering, and Institute of Biomedical Engineering, Imperial College London, London, England, UK j School of Bioscience, The University of Sheffield, Western Bank, Sheffield, England,英国约翰·范·吉斯特(John van Geest for for Cambridge)剑桥干细胞研究所,约翰·范·盖斯(John van Geest)大脑维修中心,英国剑桥大学,英国剑桥大学B UCL B UCL呼吸科,英国伦敦大学伦敦大学,英国C C C c c c c c c c c C c C c C c C c C c c in Nottingham,Intingham,Inkeration,UK Degenland,Ink degenland,degenland in notting Hiodisvery Institute of Nottingham Biodiscovery Institute of Nottingham Biodiscovery研究所波特贝洛,波多贝洛,英国,英国E E e化学工程学院,医疗保健技术研究所,翻译医学研究所伯明翰大学,伯明翰,英国,英国,英国,再生医学中心,再生和维修研究所,爱丁堡大学,爱丁堡大学,爱丁堡大学,爱丁堡生物群,小法国班级,comcotland,compland comcomply comcomply commotice commotication of Cambridge, and NHS Blood and Transplant, England, UK h Bone & Joint Research Group, Centre for Human Development, Stem Cells & Regeneration, Faculty of Medicine, University of Southampton, Southampton, England, UK i Department of Materials, Department of Bioengineering, and Institute of Biomedical Engineering, Imperial College London, London, England, UK j School of Bioscience, The University of Sheffield, Western Bank, Sheffield, England,英国
癌症易感基因的致病变异导致乳腺导管原位癌
黄怀志 1 、Ronan E. Couch 1 、Rachid Karam 2 、胡春玲 1 、Nicholas Boddicker 3 、Eric C. Polley 4 、娜洁 3 、Christine B. Ambrosone 5 、姚宋 5 、Amy Trentham-Dietz 6 、A. Heather Eliassen 7 、Kathryn Penney 7 、Kristen Brantley 7 、Clara Bodelon 8 、Lauren R. Teras 8 、James Hodge 8 、Alpa Patel 8 、Christopher A. Haiman 9 、Esther M. John 10 、Susan L. Neuhausen 11 、Elena Martinez 12 、James V. Lacey 11 、Katie M. O'Brien 13 、Dale P. Sandler 13 、Clarice R. Weinberg 13 、Julie R. Palmer 14、Kimberly A. Bertrand 14、Celine M. Vachon 3、Janet E. Olson 3、Kathryn E. Ruddy 15、Hoda Anton-Culver 16、Argyrios Ziogas 16、David E. Goldgar 17、Katherine L. Nathanson 18、Susan M. Domchek 18、Jeffrey N. Weitzel 19 、Peter Kraft 20 、Jill S. Dolinsky 2 、Tina Pesaran 2 、Marcy E. Richardson 2 、Siddhartha Yadav 1 和 Fergus J. Couch 1,3
DNA结合2抑制剂对口服鳞状细胞癌的影响
因此,在这项研究中,我们专注于ID2亚型,并决定阐明在口服鳞状细胞癌细胞中的作用。在实验中,CA9-22是一种源自人口腔鳞状细胞癌的细胞系,该细胞系未表达ID2,SAS是一种源自人口服鳞状细胞癌的细胞系,该细胞系强烈表达ID2,用于分析强制表达和抑制系统。首先,将ID2基因引入CA9-22以生成ID2,并验证了各种恶性特征,验证了蛋白质表达,并验证了基质金属蛋白酶活性。表达ID2的CA9-22细胞显着促进了增殖和侵入性能力,并且E-钙粘蛋白的表达降低,N-钙粘蛋白和波形蛋白表达得到增强。此外,观察到了蜗牛的增强表达,这是上皮 - 间质转变的标记。接下来,将ID2-反义载体引入SAS以抑制ID2表达,并验证了各种恶性特征,并以相同的方式进行了蛋白质表达分析。与强制表达实验相反,在抑制ID2表达的SAS细胞中,间充质标记的表达降低,并且侵入性能力得到了显着抑制。此外,对强制表达和抑制系统的两个分析表明,蜗牛和ID2形成复合物。