XiaoMi-AI文件搜索系统
World File Search System双重缺失的疫苗病毒哥本哈根菌株针对恶性胸膜间皮瘤
恶性胸膜间皮瘤(MPM)是缺乏有效治疗的胸膜癌。使用溶瘤疫苗病毒(VV)的溶瘤免疫治疗可能代表一种治疗这种迹象的替代治疗方法。在这里,我们研究了VV百点激酶(TK) - 核糖核苷酸还原酶(RR) - /绿色荧光蛋白(GFP)的溶瘤活性。该病毒是哥本哈根菌株的VV,该VV由编码TK(J2R)和RR(I4L)的两个基因删除,并表达GFP。首先,我们在体外表明VV TK-RR-/GFP有效地感染并杀死了本研究中使用的22个人MPM细胞系。我们还表明,该病毒在所有八个测试的MPM细胞系中都复制,但是,从一个细胞系到另一个细胞系,在扩增水平上大约有10倍的差异。然后,我们研究了伴有腹膜腹膜人类MPM Tumors的非肥胖糖尿病(NOD)严重合并免疫(SCID)小鼠的VV TK-RR-/ GFP的治疗效率。与未经治疗的动物相比,VV TK-/GFP的一种腹膜内感染会导致肿瘤负担,显着增加小鼠的存活。因此,VV TK-RR-可能是MPM溶瘤免疫疗法的有前途的溶瘤病毒(OV)。
放松和惩罚:一种新型的双重二元超参数优化方法
近年来,双重方法已经非常受欢迎,可以在机器学习模型的有效估计高维超参数上。迄今为止,二进制pa-Rameters是通过连续放松和四舍五入策略来处理的,这可能导致解决方案不一致。在这种情况下,我们通过基于适当的罚款术语求助于等效的连续二线重新构造,以应对混合二元超参数的挑战优化。我们提出了一个算法框架,在合适的假设下,可以保证提供混合二进制解决方案。此外,该方法的一般性允许在提议的框架内安全地使用现有的连续折叠求解器。我们评估了两个特定的机器学习问题的方法的性能,即,回归问题中的群 - 符号结构的估计和数据蒸馏问题。报告的结果表明,我们的方法具有基于放松和舍入的最新方法竞争。
针对克服前列腺癌耐药性的代谢脆弱性:apalutamide和复杂I抑制作用的双重治疗
摘要:前列腺癌(PCA)经常变得耐药,对有效的管理提出了重要的挑战。尽管对雄激素剥夺治疗的初始治疗可以控制晚期PCA,但随后的耐药机制允许肿瘤细胞继续生长,需要采取替代方法。这项研究深入研究了不同PCA亚型的特定代谢依赖性,并探讨了结合雄激素受体(AR)抑制(ARN具有线粒体复合物I抑制(IACS))的潜在协同作用。我们检查了正常前列腺上皮细胞(PNT1A),雄激素敏感细胞(LNCAP和C4-2)的代谢行为以及与雄激素独立的细胞(PC-3)使用ARN,IACS或组合时。结果发现了跨PCA亚型的不同线粒体活性,雄激素依赖性细胞表现出增强的氧化磷酸化(OXPHOS)。在多个PCA细胞系中,ARN和IACS辅助细胞增殖的结合。细胞生物能分析表明,IACS减少了OXPHOS,而ARN阻碍了某些PCA细胞中的糖酵解。另外,送乳糖补充破坏了代谢重编程引起的补偿性糖酵解机制。值得注意的是,葡萄糖抑制条件提高了PCA细胞对线粒体抑制的敏感性,尤其是在抗性PC-3细胞中。总体而言,这项研究阐明了PCA中AR信号传导,代谢适应性和治疗耐药性之间的复杂相互作用。这些发现提供了对亚型特异性代谢纤维文件的有价值的见解,并提出了一种有前途的策略,通过利用其代谢脆弱性来靶向PCA细胞。
由免疫检查点抑制剂治疗的III期或IV期黑色素瘤治疗的自身免疫性疾病患者的IRAE风险:匹配的病例 - 控制研究的结果 肠道微生物生物素代谢和宿主生物素状态的损害严重肥胖症:生物素和益生元补充对改善代谢的影响 最小信息用于研究细胞外囊泡(... 南大洋中翼肠科(小行星)的多样性:一种分子和形态学方法。 混合轻型态在拓扑超导体中与空腔光子搭配的 Rhynchophorus ferrugineus enerocytobiont的完整基因组序列``candidatus nardonella dyophthoridicola'' 结合缓解策略以增加生物多样性和粮食安全的共同利益 通过动态稀疏分布式内存的在线无任务持续学习 最后院子:高速加密的基础端到端验证 替莫唑胺的化学放射疗法以及Nivolumab或安慰剂的III期试验,用于新诊断的胶质母细胞瘤,甲基化的MGMT启动子 切割中的KERF锥角的实验分析 双重乳液由PGPR和阿拉伯胶作为胶囊稳定:内部液滴的令人惊讶的稳定作用
抽象目标是量化由免疫检查点抑制剂(ICI)治疗的预先存在的自身免疫性疾病(付费)患者的免疫相关不良事件(IRAE)的风险。方法 - 对照对照研究,对法国多中心前瞻性群体进行了黑色素瘤患者,与IRAE危险因素和肿瘤学分期相匹配。通过逻辑回归评估IRAE的风险。 结果包括110例有报酬的患者,并与330个对照匹配,从2013年3月到2020年10月。。 在病例中的中位随访期间,对照组为6.9个月,与对照组相比,在病例中发展全级和≥3级伊拉斯的ORS(95%CI(1.56至2.27))和1.44(分别为95%CI(1.08至1.82))。 带薪患者的多种伊拉斯(或1.46,95%CI(1.15至2.67))的风险增加,而IRAE发作的时间较短。 相比之下,与IRAE相关的死亡率或治疗率没有差异,并且具有里程碑意义的分析显示在病例中24个月的生存率更好(P = 0.02)。 30%的病例在随访期间经历了有偿爆发,基线免疫抑制并不能阻止IRAE发生。 最后,我们报告了付费临床子集与特定器官特定的IRAE之间的关联。 在我们的研究中结论是,有报酬的患者面临全级,严重和多个伊拉斯的风险,但比对照组的生存期更好的24个月。 因此,有报酬的患者应有资格接受ICI治疗,但受益于IRAE发生的密切监测,尤其是在治疗的头几个月中。通过逻辑回归评估IRAE的风险。结果包括110例有报酬的患者,并与330个对照匹配,从2013年3月到2020年10月。在病例中的中位随访期间,对照组为6.9个月,与对照组相比,在病例中发展全级和≥3级伊拉斯的ORS(95%CI(1.56至2.27))和1.44(分别为95%CI(1.08至1.82))。带薪患者的多种伊拉斯(或1.46,95%CI(1.15至2.67))的风险增加,而IRAE发作的时间较短。相比之下,与IRAE相关的死亡率或治疗率没有差异,并且具有里程碑意义的分析显示在病例中24个月的生存率更好(P = 0.02)。30%的病例在随访期间经历了有偿爆发,基线免疫抑制并不能阻止IRAE发生。最后,我们报告了付费临床子集与特定器官特定的IRAE之间的关联。在我们的研究中结论是,有报酬的患者面临全级,严重和多个伊拉斯的风险,但比对照组的生存期更好的24个月。因此,有报酬的患者应有资格接受ICI治疗,但受益于IRAE发生的密切监测,尤其是在治疗的头几个月中。
切割中的KERF锥角的实验分析双重乳液由PGPR和阿拉伯胶作为胶囊稳定:内部液滴的令人惊讶的稳定作用
hal是一个多学科的开放访问档案,用于存款和传播科学研究文件,无论它们是否已发表。这些文件可能来自法国或国外的教学和研究机构,也可能来自公共或私人研究中心。
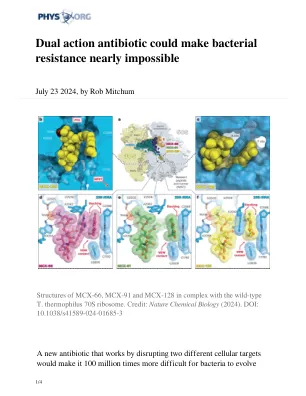
双重作用抗生素可以使细菌抗性几乎不可能
“这种抗生素的美在于它通过细菌中的两个不同靶标杀死,” UIC的杰出药物科学教授亚历山大·曼金(Alexander Mankin)说。“如果抗生素以相同的浓度击中两个靶标,则细菌通过在两个靶标中的任何一个中的随机突变获得抗药能力而失去了抗性的能力。”
组蛋白脱乙酰基酶和其他癌症的双重抑制剂 -
hal是一个多学科的开放访问档案,用于存款和传播科学研究文件,无论它们是否已发表。这些文件可能来自法国或国外的教学和研究机构,也可能来自公共或私人研究中心。
埃斯酮胺的多巴胺能作用是通过涉及谷氨酸和阿片类药物受体的双重机制介导的
Esketamine代表了一种用于治疗情绪障碍的新药物。与传统的基于单胺能的疗法不同,埃斯酮胺主要靶向N-甲基-D-天冬氨酸受体(NMDAR)。然而,埃斯酮胺是一种复杂的药物,对NMDAR具有低亲和力,也可以与其他靶标(例如阿片受体)结合。其抗抑郁特性的精确作用机理仍然存在争议,其滥用的潜力也是如此。情绪和奖励处理交集的关键组成部分是多巴胺能系统。在这项研究中,我们使用行为模型和体内纤维光度法来探索小鼠伏隔核中埃斯酮胺的神经化学作用。我们的发现证明了埃斯酮胺对细胞外多巴胺动力学的多模式影响。通常,埃斯酮胺会增加多巴胺能的张力,同时减少谷氨酸能传播。然而,它减少了多巴胺的阶段性活性并损害了奖励诱发的多巴胺释放。这些作用部分,有条件地被阿片类拮抗剂纳洛酮阻塞,需要谷氨酸能输入。总而言之,我们的研究揭示了神经递质系统之间的复杂相互作用,这表明埃斯酮胺的神经化学作用既依赖电路和状态依赖性。
CSMD1中的双重变体与具有智力障碍和可变皮质畸形的神经发育障碍有关
csmd1(幼崽和寿司多个域1)是补体级联反应的补体级联反应的重要组成部分。csmd1在中枢神经系统(CNS)中高度表达,其中补体途径的紧急功能调节神经发育和突触活动。虽然神经精神疾病的遗传危险因素,但CSMD1在神经发育疾病中的作用尚不清楚。通过国际变体共享,我们确定了来自六个不同血统家族的八个人的遗传性双重CSMD1变体,这些人出现了全球发育迟缓,智力障碍,小头畸形和多毛糖。我们在早期前脑前脑器类器官中对CSMD1功能丧失(LOF)发病进行了建模,该器官与CSMD1基因敲除人类胚胎干细胞(HESC)区分开。我们表明,CSMD1对于神经上皮细胞结构和同步分化是必需的。总而言之,我们确定了CSMD1在大脑发育和双重CSMD1变体中的关键作用,是先前未固定的神经发育障碍的分子基础。