XiaoMi-AI文件搜索系统
World File Search SystemRAAV制造的一种新颖的合成DNA替代品
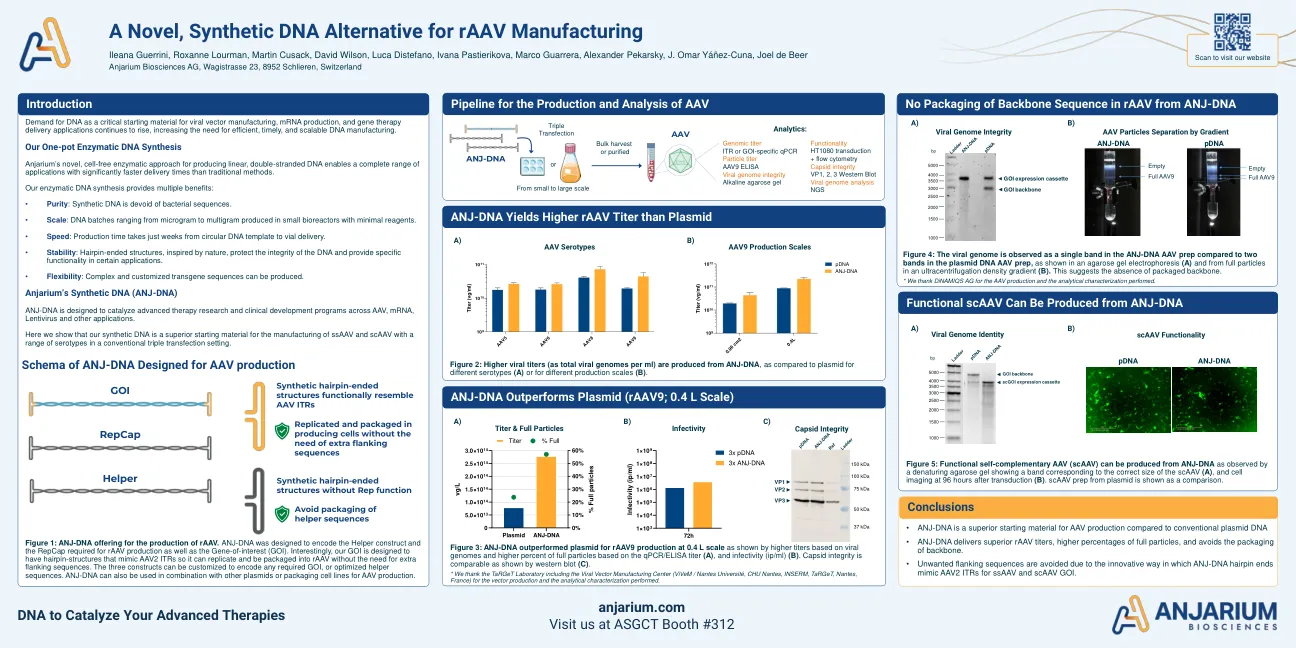
图1:ANJ-DNA生产Raav。anj-DNA旨在编码辅助构建体和RAAV生产所需的repcap以及利益基因(GOI)。有趣的是,我们的GOI旨在具有模仿AAV2 ITR的发夹结构,因此可以复制并将其包装到Raav中,而无需额外的侧翼序列。可以定制这三个构造以编码任何必需的GOI或优化的助手序列。ANJ-DNA也可以与其他质粒或包装细胞系组合使用,以进行AAV产生。
改进的 gRNA 二级结构允许编辑抵抗 CRISPR-Cas9 切割的靶位
CRISPR-Cas9 介导的基因组编辑的第一步是切割与 CRISPR 向导 RNA (gRNA) 中所谓的间隔序列互补的目标 DNA 序列。然而,一些 DNA 序列对 CRISPR-Cas9 切割具有抵抗性,这至少部分是由于 gRNA 折叠错误造成的。为了解决这个问题,我们设计了 gRNA,使其恒定部分具有高度稳定的发夹结构,并通过化学修饰进一步增强了它们的稳定性。“基因组编辑优化锁定设计”(GOLD)-gRNA 将基因组编辑效率提高了约 1000 倍(从 0.08% 到 80.5%),其他不同靶标的平均效率提高了 7.4 倍。我们预计,无论间隔序列组成如何,这种改进的 gRNA 都将实现高效编辑,并且在所需的基因组位点难以编辑时将特别有用。
改进的 gRNA 二级结构允许编辑抵抗 CRISPR-Cas9 切割的靶位
CRISPR-Cas9 介导的基因组编辑的第一步是切割与 CRISPR 向导 RNA (gRNA) 中所谓的间隔序列互补的目标 DNA 序列。然而,一些 DNA 序列对 CRISPR-Cas9 切割具有抵抗性,这至少部分是由于 gRNA 折叠错误造成的。为了解决这个问题,我们设计了 gRNA,使其恒定部分具有高度稳定的发夹结构,并通过化学修饰进一步增强了它们的稳定性。“基因组编辑优化锁定设计”(GOLD)-gRNA 将基因组编辑效率提高了约 1000 倍(从 0.08% 到 80.5%),其他不同靶标的平均效率提高了 7.4 倍。我们预计,无论间隔序列组成如何,这种改进的 gRNA 都将实现高效编辑,并且在所需的基因组位点难以编辑时将特别有用。
肽融合提高主要编辑效率 1
Prime editing 是一种基于 CRISPR 的“搜索和替换”技术,可在没有双链断裂 (DSB) 或供体 DNA 模板 1 的情况下,在哺乳动物细胞中介导靶向 32 插入、删除和所有可能的碱基对碱基转换。Prime editing 34 酶 (PE2) 由与工程逆转录酶 (RT) 融合的 SpCas9 切口酶组成。35 PE2 通过 Prime editing 向导 RNA (pegRNA) 被招募到目标位点,该 RNA 除了标准基因组靶向间隔区和 SpCas9 结合发夹结构外,还包含 3' 序列,37 该序列充当融合 RT 的模板,以在一条切口 DNA 链上合成编程的 DNA 序列。当细胞 DNA 修复机制修复断裂的链时,这种 RT-39 延伸片段会与未编辑的片段竞争,而编辑后的序列有时会取代基因组中的原始序列 1,2。41
在DNA复制期间从模板切换中产生从头miRNA
即使对于具有极为约束的设计的microRNA(miRNA)基因,生成新基因和遗传信息的机制也是鲜为人知的。所有miRNA主要转录物都需要折叠成干循环结构,以产生与结合和拒绝其mRNA靶标结合和倒置的短基因产物(约22 nt)。虽然大量的miRNA基因是古老且高度保守的,但已证明编码完全新颖的miRNA基因的短次级结构以谱系特异性的方式出现。模板切换是一种与DNA复制相关的突变机制,可以在单个事件中引入复杂的变化并为整个发夹结构生成完美的基础配对。在这里我们表明,模板开关突变(TSM)参与了灵长类动物谱系中6,000多个合适的发夹结构的出现,以产生至少18个新的人类miRNA基因,即自从灵长类动物起源以来就已经出现的miRNA的26%。虽然该机制似乎是随机的,但TSM生成的miRNA富含内含子,可以用其宿主基因表达它们。TSM事件的高频提供了进化的原材料。比从从头创建基因创建的其他机制快的速度要快,TSM生成的miRNA可以使遗传信息的近乎静止状态和快速适应不断变化的环境。
使用息肉素反向Hoogsteen发夹技术对点突变的基因校正
单基因疾病通常是特定基因单点突变的结果,导致非功能蛋白的产生。不同的血液疾病,例如β-丘脑贫血,镰状细胞病,遗传性球细胞增多症,fanconi贫血和血友病A和B,通常是由点突变引起的。基因编辑工具,包括Talens,ZFN或CRISPR/CAS平台,以纠正负责不同疾病的突变。然而,不依赖核酸酶活性的替代分子工具,例如形成三核苷酸及其衍生物(例如肽核酸),也证明了它们在DNA中纠正突变的能力。在这里,我们回顾了修复 - 螺肽反向Hoogsteen发夹(PPRHS)技术,该发夹可以代表该领域内的替代基因编辑工具。修复-PPRHS是由由五甲状腺素桥连接的两个息肉素镜重复序列形成的单链DNA分子,然后在分子的一端进行扩展序列,该序列是与DNA序列同源的,但要修复了DNA序列,但含有修复的DNA序列。PPRH的两个息肉臂由嘌呤之间的分子内反间隔键结合,从而形成了发夹结构。该发夹芯与watson-crick键以序列特异性方式与dsDNA中靶突变相对近乎近距离突变结合,从而产生了刺激重组的三重结构。这项技术已成功地用于修复其内源性基因座中DHFR和APRT基因突变体在哺乳动物细胞中的集合,并且可以适合校正负责血液疾病的突变。