XiaoMi-AI文件搜索系统
World File Search System参考ID:5513870 -AccessData.fda.gov
眼不良反应:DATROWAY可能会引起眼部不良反应,包括干眼症,角膜炎,孔全肾炎和Meibomian腺体功能障碍,增加的泪腔,结膜炎和视力模糊。在用Datroway治疗期间,监测患者的眼部不良反应。建议患者使用防腐剂 - 无润滑眼滴,并避免在Datroway治疗期间使用隐形眼镜。剂量延迟,剂量减少或根据眼部不良反应的严重程度永久停止Datroway。将患者参考任何新的或恶化的眼部体征和症状的患者。(2.2,2.3,5.2)口腔炎/口腔粘膜炎:Datroway会引起口腔溃疡,包括口腔溃疡和口服粘膜炎。建议患者在开始治疗时使用含类固醇的漱口水,并在注入Datroway时将冰片或冰水固定在口腔中。基于不良反应的严重程度,预扣,剂量减少或永久停止Datroway。(2.2,2.3,5.3)胚胎毒性毒性:Datroway可能造成胎儿伤害。建议患者对胎儿的潜在风险并使用有效的避孕。(5.4,8.1,8.3)
多重性无复杂性。
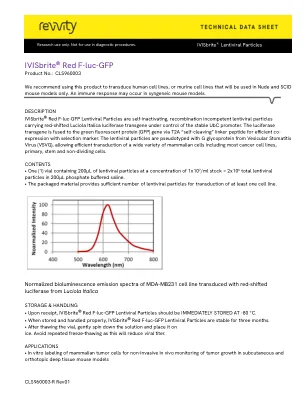
ivisbrite红色f-luc-gfp慢病毒颗粒是自动激活的,重组无能力的慢病毒颗粒,这些颗粒载有红移的卢西里卡意大利荧光素酶透明酶转基因在稳定的UBC启动子的控制下。通过T2A“自切除”接头肽将荧光素酶转基因融合到绿色荧光蛋白(GFP)基因中,以有效地与选择标记物共同表达。慢病毒颗粒从囊泡口腔炎病毒(VSVG)中用G糖蛋白进行拟型型,从而有效地转导了多种哺乳动物细胞,包括大多数癌细胞系,原发性,茎和非生动细胞。含量•一(1)个小瓶,含有200μl的慢病毒颗粒,浓度为1x10 7 /ml库存= 2x10 6在200μl磷酸盐缓冲盐水中的总慢病毒颗粒。•包装材料提供了足够数量的慢病毒颗粒,可至少转导一条细胞系。
lyfgenia®(lovotibeglogene autotemcel)
lyfgenia(lovotibeglogene autotemcel)用于治疗12岁或以上患有镰状细胞疾病的患者和血管熟悉事件的病史(VOES)。Lyfgenia的批准是基于在一项单臂,24个月,开放标签的多中心1/2研究中证明的疗效,该研究继续进行了长期的随访研究。在过去的24个月中,在43名患者中至少有4个VOE的患者中,有36名患者成功接受了骨髓性的Busulfan条件和Lyfgenia。在输注Lyfgenia后6个月至18个月之间,有效性结果是对VOE(VoeCr)和严重VOE(SVOE-CR)的完全分辨率。28/32患者完全分辨出VOE(88%,95%CI:71,97)和30/32的严重VOE(94%,95%CI:79,99)。最常见的不良反应≥3级(发病率≥20%)是口腔炎,血小板减少症,中性粒细胞减少症,发热性中性粒细胞减少症,贫血和白细胞减少症。
以 Inavolisib 为基础的 PIK3CA 突变晚期乳腺癌治疗
结果 共有 161 名患者被分配到 inavolisib 组,164 名患者被分配到安慰剂组;中位随访期分别为 21.3 个月和 21.5 个月。inavolisib 组的中位无进展生存期为 15.0 个月(95% 置信区间 [CI],11.3 至 20.5),安慰剂组为 7.3 个月(95% CI,5.6 至 9.3)(疾病进展或死亡的风险比为 0.43;95% CI,0.32 至 0.59;P<0.001)。inavolisib 组 58.4% 的患者出现客观缓解,安慰剂组 25.0% 的患者出现客观缓解。 3 级或 4 级中性粒细胞减少症的发生率在 inavolisib 组为 80.2%,在安慰剂组为 78.4%;3 级或 4 级高血糖的发生率分别为 5.6% 和 0%;3 级或 4 级口腔炎或黏膜炎症的发生率分别为 5.6% 和 0%;3 级或 4 级腹泻的发生率分别为 3.7% 和 0%。未观察到 3 级或 4 级皮疹。因不良事件而停用任何试验药物的患者在 inavolisib 组为 6.8%,在安慰剂组为 0.6%。
NOG1通过靶向磷酸化的干扰素调节因子3
先天免疫系统是宿主防御的第一线,研究干扰素(IFN)信号负调控的机制对于维持先天免疫反应的平衡很重要。在这里,我们发现宿主GTP结合蛋白4(NOG1)是先天免疫反应的负调节剂。NOG1的过表达抑制了病毒RNA和DNA介导的信号通路,NOG1缺乏症促进了抗病毒先天免疫反应,从而导致NOG1促进病毒复制的能力。囊泡口腔炎病毒(VSV)和单纯疱疹病毒1型(HSV-1)感染诱导NOG1缺乏小鼠的IFN-β蛋白较高水平。同时,NOG1缺陷型小鼠对VSV和HSV-1感染更具抗性。NOG1通过靶向IRF3抑制I型IFN产生。nog1与磷酸化的IFN调节因子3(IRF3)相互作用,以损害其DNA结合活性,从而下调IFN-β和下游IFN刺激基因(ISGS)的转录。NOG1的GTP结合域是负责此过程的原因。总而言之,我们的研究揭示了NOG1如何通过靶向IRF3对IFN-β进行负面影响的潜在机制,该机制发现NOG1在宿主先天免疫中的新作用。
内质网应激诱导的细胞死亡作为...
摘要。最近的研究集中在鉴定新型靶向剂,以减少常规化学治疗剂对正常细胞的不希望的副作用。但是,即使是靶向疗法也可能对健康组织产生某些负面影响。目前的系统审查是为了评估接受依维莫司治疗的患者的副作用的类型和发生率。使用以下免费单词和网格术语搜索了PubMed和Scopus数据库:“ Everolimus”和“副作用”或“毒性”或“不良事件”。根据标题和摘要筛选了总共912项潜在的相关研究。共有731个被排除在外,因为他们不符合纳入标准。包括包括在内的剩余研究中,获得了报告的不良事件。报告的主要不良事件是口腔炎,白细胞,厌食症,贫血和疲劳。大多数患者报告的不良事件仅限于1级或2级。总体上,本文提供的数据证实了先前有关依维洛木斯(Everolimus)的相对安全性的研究结果,依维莫司(Everolimus)是一种靶向治疗剂,与常规化学疗法不同,并突出了通过依依他木斯(Everolimus)治疗的潜在不良事件。
慢病毒载体假型:改善造血细胞基因修饰的珍贵工具用于研究和基因治疗
摘要:通过将病毒转化为病毒载体,已将病毒重新用于用于基因递送的工具。最常用的载体是慢病毒载体(LVS),这些载体源自人类免疫缺陷病毒,允许哺乳动物细胞中有效基因转移。它们代表了影响造血系统的最安全,最有效的治疗方法之一。LV通过不同的病毒信封(假型)进行修饰,以改变和改善其对不同原发性细胞类型的端主。囊泡口腔炎病毒糖蛋白(VSV-G)通常用于假型,因为它增强了基因转移到多种造血细胞类型中。然而,VSV-G假型LV无法在静态血细胞(例如造血干细胞(HSC),B和T细胞)中赋予有效的转导。为解决此问题,可以将VSV-G交换为其他异源病毒包膜糖蛋白,例如麻疹病毒,狒狒内源性逆转录病毒,Cocal病毒,Nipah病毒或仙境病毒的糖蛋白。在这里,我们提供了这些LV伪型如何改善HSC,B,T,T和自然杀伤(NK)细胞的转导效率,并通过多个体外和体内研究强调了拟型LV提供治疗基因或基因编辑工具的概括性遗传和癌细胞的概述。
MTOR抑制剂的血液学毒性是温和的,剂量... 叙事回顾了蒂尔扎epatide在解决2型糖尿病和肥胖管理中的作用的临床证据
在一个人[2]中。大约有90%的TSC患者患有中枢神经系统表现,例如癫痫,智障,自闭症谱系障碍和/或注意力缺陷/多动障碍[也称为TSC相关的神经精神疾病(TAND)] [3,4]。在2021年,国际结节硬化共识小组更新了TSC诊断标准,监视和管理建议[5]。多年的研究和临床试验允许将MTOR抑制剂引入两种TSC的分类。现有1的研究证实了依维莫司(Everolimus)的有效性和安全性,作为亚依赖性巨型细胞星形胶质细胞(SEGA)的患者的治疗选择[6]。现有2的研究表明,依维莫司是与TSC相关的肾血管肌瘤的有效治疗方法。《现有2研究》中最常见的药物不良事件是口腔炎,鼻咽炎和痤疮样皮肤病变。血液学并发症报告了一小部分患者。最常见的是贫血(n = 10,13%)和白细胞减少症(n = 8,10%)。然而,没有任何案例被归类为3+,正如公共术语标准(CTCAE)(CTCAE),版本3.0(CTCAE v3.0)所定义的[7,8]。我们的大型研究结果表明,可以使用MTOR抑制剂的维持剂量来最大程度地减少依维莫司治疗的不良影响,同时对SEGA进行充分控制[9]。这项研究的目的是评估在标准剂量治疗期间因SEGA肿瘤和降低剂量后,因SEGA肿瘤而受到的TSC患者的血液学参数的影响。
酒精和牙周疾病:叙事评论
涉及酒精和酒精饮料的科学文献表明,这些饮料对牙周组织具有不利影响。此外,其他主要风险因素包括烟草,吸烟,口腔卫生差等。已经观察到,在慢性酒精中毒中,还有进一步的问题,例如精神,社会和身体影响,可以促进酒精中毒。这些人可能对防御致病生物和细菌的防御能力较弱。因此,存在牙龈出血,牙龈肿胀,口臭和骨质流失的机会。市场上不同的酒精饮料会导致唾液不足;这些饮料含有糖,可通过将搪瓷矿物质和损坏牙龈和牙齿延伸的病原体在口腔中促进酸产生。这种长期的饮酒量可以发展为不同类型的口腔疾病,包括癌症,口腔症和龋齿,也与烟草和吸烟有关。慢性饮酒会导致口服微生物组的改变并增加口腔病原体,从而导致牙周疾病和由于营养不良,免疫力降低,肝脏状况改变,脑损伤和肠道菌群改变而导致体内产生的炎症环境。颜色为牙齿的颜色鲜艳的饮料会在牙齿上染色,并且由于唾液较少,可能会对牙周造成其他毒性作用。对酒精的过度依赖性导致坏死病变,例如坏死性牙龈炎,坏死性牙周炎和坏死性口腔炎。这些病理障碍会严重损害口服结构。因此,迫切需要患者的牙科外科医生和相关卫生专业人员的适当咨询,因为个人病例需要远离定期大量饮酒。
靶向抗癌治疗的口腔内毒性
[1] Sibaud V、Lamant L、Maisongrosse V、Delord JP。 BRAF 抑制剂皮肤产生不良影响:系统评论。安德玛托性病 2013;140:510—20。 [2] Robert C、Sibaud V、Mateus C、Cherpelis BS。靶向治疗皮肤毒性管理的进展。塞明·昂科尔 2012;39:227—40。 [3] Robert C, Mateus C, Spatz A, Wechsler J, Escudier B. 与多激酶抑制剂索拉非尼相关的皮肤病症状。 J Am Acad Dermatol 2009;60:299—305。 [4] Robert C,Soria JC,Spatz A,Le Cesne A,Malka D,Pautier P 等。激酶抑制剂和阻断抗体的皮肤副作用。Lancet Oncol 2005;6:491—500。[5] Watters AL,Epstein JB,Agulnik M。癌症靶向治疗的口腔并发症:叙述性文献综述。Oral Oncol 2011;47:441—8。[6] Rosen AC,Gavrilovic IT,Balagula Y,Ramaswamy V,Dickler MN 等。血管生成抑制剂引起的地图舌:回复。Oncologist 2013;18:e18。[7] De Oliveira MA,Martins E,Martins F,Wang Q,Sonis S,Demetri G 等。mTOR 抑制剂相关口腔炎的临床表现和治疗。 Oral Oncol 2011;47:998—1003。[8] Sonis S, Treister N, Chawla S, Demetri G, Haluska F. 抑制剂相关口腔病变的初步表征