XiaoMi-AI文件搜索系统
World File Search System来那替尼(Nerlynx)
• 来那替尼是一种口服药物。通常,您每天服用一次 240 毫克(6 片)。 • 为了提高耐受性并降低腹泻发生率,可以采用剂量递增策略。您的治疗团队可能会告诉您按照下表服用来那替尼(每片来那替尼为 40 毫克):
基于知识的机制模型可准确预测 EGFR 突变肺腺癌中吉非替尼的病情进展
肺腺癌 (LUAD) 与晚期低存活率相关。尽管靶向疗法的发展已经改善了具有已识别的特定基因改变(例如表皮生长因子受体基因 (EGFR) 上的激活突变)的 LUAD 患者的预后,但肿瘤耐药性的出现最终会发生在所有患者中,这推动了新疗法的开发。在本文中,我们提出了 In Silico EGFR 突变型 LUAD (ISELA) 模型,该模型将 LUAD 患者的个体特征(包括肿瘤遗传异质性)与第一代 EGFR 酪氨酸激酶抑制剂吉非替尼作用下的肿瘤大小演变和肿瘤随时间的进展联系起来。该转化机制模型收集了有关 LUAD 的广泛知识,并在多个尺度上进行了校准,包括体外、人肿瘤异种移植小鼠和人类,重现了 90% 以上的已识别实验数据。此外,该模型的覆盖率为 98.5%,负对数秩检验为 99.4%,准确重现了 Lux-Lung 7 临床试验中的进展时间,该试验在校准中未使用,因此支持该模型具有较高的预测价值。这种基于知识的机制模型可以成为开发针对 EGFR 突变 LUAD 的新疗法的宝贵工具,为生成合成对照组奠定基础。
第 42 届国际噪声大会和博览会...
穆罕默德·塔希尔·阿赫塔尔、法比恩·安福索、豪尔赫·阿里纳斯、努尔丁·阿塔拉、基思·阿滕伯勒、迈克·巴蒂亚里昂、戴尔芬·巴德、汉斯·本特森、弗里茨·范登伯格、马丁·范登伯格、特鲁斯·伯格、伯纳德·贝里、安妮莉丝·博克斯塔尔、杰拉德·博雷洛、迪克·博特尔杜伦、马克·布林克、桑德拉·布里克斯、罗伯特·L·布朗斯登、莱克斯·布朗、考特尼·巴勒斯让-皮埃尔·克莱尔布瓦、夏洛特·克拉克、路易斯·本托·科埃略、多米尼克·科林、史蒂芬·C·康伦、乔·库基耶里、帕特里夏·戴维斯、约翰·劳伦斯·戴维、弗朗西斯科·D·德尼亚、福特·德鲁、科尼利厄斯·杜兰、纪尧姆·杜蒂利厄、阿德里安·艾格、Tamer Elnady、雨果·法斯特、托马斯·费特克、安德烈·菲比格、萨尔瓦多·菲格罗亚、海因茨·马丁·费舍尔、伊恩·弗林德尔、 Adrian Fuente、Aslak Fyhri、Massimo Garai、David Pelegrin Garcia、Juan Jesus Garcia、Denis Gely、Klaus Genuit、Samir N.Y.格尔格斯、埃迪·格雷森、贝里·吉布斯、安妮塔·吉德洛夫-冈纳森、吕克·古伯特、伊达尔·格兰诺恩、科林·格里姆伍德、凯茜·吉古-卡特、克拉斯·哈格伯格、穆罕默德-阿里·哈姆迪、卡尔-克里斯蒂安·汉奇克、马库斯·赫克特、卡尔·霍普金斯、约恩·胡贝尔特、斯塔凡Hygge、Jeong Guon Ich、Bart Ingelaere、Ullrich Isermann、Sabine詹森、迪伦·琼斯、曼弗雷德·卡尔滕巴赫、艾琳·范·坎普、康健、史蒂芬·基思、罗尼·克拉博、伊冯·德·克鲁泽纳尔、让-吕克·库朱姆吉、安妮特·克鲁格-多克特、帕特里克·库尔茨、桑诺子、Soogab Lee、Peter Lercher、李凯明, 卢静, Luigi Maffei, Jeffrey Mahn, Thomas Maly, Toshihito Matsui, Young J. Moon、Mats E Nilsson、Svein Arne Nordby、Mikael Ögren、Jorge Patricio、Eja Pedersen
基于尼宁的治疗
缺乏对抗木质甲壳虫Fastidiosa(XF)的可持续策略突出了对新型实用抗菌工具的紧迫需求。在这项研究中,乳酸乳酸乳酸亚生成乳杆菌。乳酸菌株ATCC 11454(乳酸乳杆菌)以其生产奈瑟蛋白A而闻名,对XF亚种进行了体外测试。pauca。初步研究表明,乳乳杆菌对XF表现出强的拮抗活性。因此,通过体外和植物实验的结合,对尼沙蛋白A的功效进行了全面评估。采用可行的定量PCR,点测定,浊度降低测定,荧光显微镜和透射电子显微镜的体外研究表明,在最小的0.6 mg/mL的最小致死浓度下,尼沙蛋白对XF的鲁棒性杀菌作用。由荧光和透射电子显微镜产生的结果表明,尼沙蛋白直接和快速与XF细胞的膜相互作用,从而导致细菌细胞在几分钟内破坏。在Planta测试中,Nisin还证明了在接种后74天无症状74天内解决烟草本植物中XF感染的能力。此外,RPLC-ESI-MS/MS分析表明,尼生蛋白转移到植物的所有部分,并保持完整长达9天。首次,这项研究强调了基于尼我们的策略,作为一种现实且环保的方法,可以进一步研究该领域的XF感染。
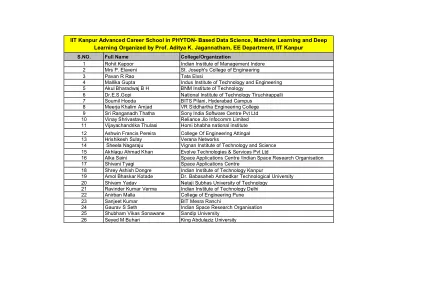
IIT 坎普尔高级职业学校 Python 数据科学、机器学习和深度学习 (回复).xlsx
12 Ashwin Francis Pereira 工程学院 Attingal 13 Hrishikesh Sulay Verana 网络 14 Sheela Nagaraju Vignan 理工学院 15 Akhlaqu Ahmad Khan Evolve Technologies & Services Pvt Ltd 16 Alka Saini 空间应用中心/印度空间研究组织 17 Shivani Tyagi 空间应用中心 18 Shrey Ashish Dongre 印度理工学院坎普尔分校 19 Amol Bhaskar Kotade Dr.巴巴萨海布·安贝德卡尔科技大学 20 希瓦姆·亚达夫·内塔吉·苏巴斯科技大学 21 拉文德·库马尔·维尔马印度理工学院德里分校 22 阿尼尔班·马拉工程学院浦那分校 23 桑吉特·库马尔 BIT 梅斯拉兰契分校 24 高拉夫·S·塞斯印度空间研究组织 25 舒巴姆·维卡斯·索纳瓦内·桑迪普大学 26 赛义德·M·布哈里阿卜杜勒阿齐兹国王大学
对于患者:Zanubrutinib
• 赞布替尼 (zan” ue broo' ti nib) 是一种用于治疗某些类型癌症的药物。它是一种口服胶囊。 • 在服用赞布替尼之前,请告知医生您是否曾对赞布替尼产生过异常或过敏反应。 • 治疗期间可能会定期进行血液检查。根据检查结果和/或其他副作用,您的治疗剂量和时间可能会发生变化。 • 严格按照医生的指示服用赞布替尼非常重要。确保您了解说明。 • 您可以随餐或空腹服用赞布替尼。 • 如果您每天服用一次赞布替尼,并且漏服了一剂,请在漏服后 12 小时内尽快服用。如果距漏服时间已超过 12 小时,请跳过漏服剂量并恢复正常服药时间。不要服用双倍剂量来弥补漏服剂量。
官方公报的正字法章程 法律和法令
阿谢尔、艾格雷蒙、安德烈西、巴佐什叙吉约讷、布瓦达尔西、布吉瓦尔、比克、比什莱、卡里埃苏普瓦西、卡里埃叙塞纳、拉塞勒圣克卢、尚布尔西、尚特卢-葡萄园、沙佩、沙图、勒谢奈、谢夫勒斯、莱克莱苏布瓦、夸尼埃、孔夫朗圣奥诺里纳、塞纳河畔克鲁瓦西、埃朗库尔、莱唐拉维尔、埃韦克蒙特、福兰维尔德内蒙特、丰特奈-le-Fleury、Fourqueux、Gaillon-sur-Montcient、Gargenville、Guyancourt、Hardricourt、Houilles、Issou、Jouars-Pontchartrain、Jouy-en-Josas、Juziers、Limay、Les Loges-en-Josas、Louveciennes、马尼昂维尔、马尼莱阿莫、迈松拉菲特、芒特拉若利、芒特拉维尔、马雷伊马尔利、马尔利勒鲁瓦、莫尔库尔、莫尔帕、棉兰、勒梅尼勒鲁瓦、勒梅尼-圣丹尼斯、默朗、塞纳河畔梅齐、蒙特松、蒙蒂尼布勒托讷、莱米罗、诺夫勒堡、诺夫勒维约、奥日瓦尔、勒佩克、普莱西、普瓦西、波尔舍维尔、勒波尔马尔利、罗康库尔、圣西尔莱科勒、圣日尔曼昂莱、圣雷米莱谢夫勒斯、圣雷米洛诺雷、萨特鲁维尔、特拉普、莫尔德尔河畔勒特朗布莱、特里尔叙尔-塞纳省, 塞纳河畔沃,韦利济-维拉库布莱、韦尔讷伊、韦尔努耶特、拉韦里埃、凡尔赛、勒韦西内、维尔奈、维尔普勒、维利耶圣弗雷德里克、维罗弗莱、瓦桑勒布勒托讷。
BI6727 是一种 polo 样激酶 1 抑制剂,可与吉非替尼协同作用,通过 G2/M 阻滞机制抑制肝细胞癌细胞
肝细胞癌 (HCC) 是癌症死亡的第二大原因,这表明迫切需要有效的干预药物或策略来对抗 HCC。在本研究中,我们首先发现吉非替尼(一种 EGFR 抑制剂)和 BI 6727(一种 pol o 样激酶 1 (PLK1) 抑制剂)的组合可以显著抑制 HCC 细胞的细胞增殖,从而减弱 HCC 细胞对吉非替尼的获得性耐药性。有趣的是,我们的结果表明吉非替尼与 BI6727 组合的抗肿瘤作用与 G2/M 停滞有关。此外,进一步的研究表明,BI6727 可以通过泛素化依赖性途径下调细胞分裂周期 25C (Cdc25C) 的蛋白水平,随后诱导 G2/M 停滞。此外,在吉非替尼与BI6727联合使用时,HCC细胞中两个关键的检查点蛋白毛细血管扩张性共济失调突变(p-ATM)/ ATM和Rad-3相关(p-ATR)以及DNA损伤的另一个标志性磷酸化H2AX (γ-H2AX)受到正向调节。这些结果表明联合治疗诱导的G2/M停滞与DNA损伤密切相关。总之,本研究发现吉非替尼与BI6727协同作用可以显著促进DNA损伤并克服HCC细胞对吉非替尼的获得性耐药性。我们的研究为EGFR抑制剂和PLK1抑制剂联合用于HCC的临床治疗提供了一种有希望的方法。
在三阴性乳腺癌细胞中,使用吉非替尼和依维莫司共同靶向 EGFR 和 mTOR
三阴性乳腺癌 (TNBC) 不太可能对激素疗法和抗 HER2 靶向疗法产生反应。TNBC 过度表达 EGFR 并表现出 PI3K/AKT/mTOR 信号通路的组成性激活。我们假设同时阻断 EGFR 和 mTOR 可能是治疗 TNBC 的潜在治疗策略。我们研究了 mTOR 抑制剂依维莫司与 EGFR 酪氨酸激酶抑制剂吉非替尼联合在有或没有 PI3K/AKT/mTOR 信号通路激活突变的 TNBC 细胞中的抗肿瘤活性。我们证明依维莫司和吉非替尼在 PI3K 和 PTEN 突变的 CAL-51 细胞系中诱导协同生长抑制,但在 PTEN 缺陷的 HCC-1937 细胞系中没有诱导协同生长抑制。抗增殖作用与 mTOR 和 P70S6K 磷酸化的协同抑制以及 CAL-51 细胞系中 4E-BP1 活性的显著降低有关。我们还表明,联合疗法显著抑制了该细胞系的细胞周期进程并增加了细胞凋亡。基因和蛋白质表达分析表明,联合治疗后细胞周期调节因子显著下调。总之,这些结果表明,mTOR 和 EGFR 的双重抑制可能是治疗 PI3K 激活突变的 TNBC 的有效方法。