XiaoMi-AI文件搜索系统
World File Search System处方信息重点
1 适应症和用法 ................................. 3 2 剂量和给药 ........................ 3 2.1 推荐剂量 ...................................... 3 2.2 安全性监测 ...................................... 3 2.3 漏服剂量 ...................................... 3 2.4 因计划的外科手术或其他干预而中断剂量 ................ 3 2.5 因不良反应调整剂量 ........................ 3 3 剂型和强度 ...................................... 5 4 禁忌症 ...................................... 5 5 警告和注意事项 ...................................... 5 5.1 出血 ...................................... 5 5.2 腹泻 ...................................... 6 5.3 血小板减少 ...................................... 6 5.4 QT 间期延长 ...................................... 6 5.5 主要不良心脏事件 (MACE) 7 5.6 血栓形成 ...................................... 7 5.7 继发性恶性肿瘤 ................................ 7
处方信息重点
警告:药物引起的肝损伤和肝功能衰竭 接受 ALYFTREK 治疗的患者中已观察到转氨酶升高。在服用含有 elexacaftor、tezacaftor 和 ivacaftor 的固定剂量组合药物的患者中,已报告出现严重且可能致命的药物引起的肝损伤和肝功能衰竭病例,该组合药物含有与 ALYFTREK 相同或相似的活性成分。在治疗的第一个月内以及开始使用 elexacaftor/tezacaftor/ivacaftor 后长达 15 个月内,已报告出现肝损伤[见警告和注意事项 (5.1) 和不良反应 (6)]。在开始使用 ALYFTREK 之前,应对所有患者进行肝功能检查 (ALT、AST、碱性磷酸酶和胆红素) 评估,在治疗的前 6 个月内每月进行一次,然后在接下来的 12 个月内每 3 个月进行一次,之后至少每年进行一次。对于有肝病史或基线时肝功能检查升高的患者,考虑更频繁地监测[见剂量和给药方法(2.1)、警告和注意事项(5.1)、不良反应(6)、和特殊人群中的使用(8.7)]。肝功能检查显著升高或出现肝损伤的体征或症状时,中断 ALYFTREK。考虑转诊至肝病科医师。通过临床和实验室监测密切跟踪患者直至异常消退。如异常消退,只有预计获益大于风险时才恢复治疗。恢复 ALYFTREK 后建议更密切的监测[见警告和注意事项(5.1)]。重度肝功能不全(Child-Pugh C 类)患者不应使用 ALYFTREK。不建议中度肝功能不全(Child-Pugh B 类)患者使用 ALYFTREK,并且只有在有明确的医疗需要并且获益大于风险时才应考虑。如果使用,密切监视患者[见剂量和给药方法(2.4)、警告和注意事项(5.1)、不良反应(6)、特殊人群中的使用(8.7)和临床药理学(12.3)]。 1 适应症和用途 ALYFTREK 适用于治疗 6 岁及以上患有囊性纤维化(CF) 患者的囊性纤维化跨膜传导调节器 (CFTR) 基因中至少有一个 F508del 突变或另一个反应性突变(见表 5)[见临床药理学(12.1)]。如果患者的基因型未知,应使用 FDA 批准的 CF 突变测试来确认存在至少一种指示突变。 2 剂量和给药 2.1 开始 ALYFTREK 前和治疗期间建议进行的实验室检测 开始 ALYFTREK 前,对所有患者进行肝功能检测 (ALT、AST、碱性磷酸酶和胆红素)。治疗前 6 个月每月监测一次肝功能检测,接下来 12 个月每 3 个月监测一次,之后至少每年监测一次。对有肝病史、基线时肝功能检查升高、或使用含 elexacaftor、tezacaftor、和/或 ivacaftor 药物时肝功能检查升高史患者考虑更频繁监测[见警告和注意事项(5.1)和特殊人群中的使用(8.7)]。 2.2 推荐剂量 表 1 提供成人和 6 岁及以上儿童患者的推荐 ALYFTREK 剂量。每天一次口服 ALYFTREK (将药片整个吞下) 与含脂肪食物一起服用,每天大约同一时间[见临床药理学(12.3)]。含脂肪的餐食或零食的例子是用黄油或油制备的餐食或含有鸡蛋、花生酱、奶酪、坚果、全脂牛奶或肉类的餐食。
Auvelity™ 处方信息
警告和注意事项 • 癫痫:风险与剂量有关。如果发生癫痫,请停药。(4、5.2) • 血压升高和高血压:AUVELITY 可升高血压并导致高血压。在开始治疗前评估血压,并在治疗期间定期监测。(5.3) • 躁狂症或轻躁狂症的发作:筛查患者是否患有躁郁症。(5.4) • 精神病和其他神经精神反应:指导患者如果发生此类反应,联系医疗保健提供者。(5.5) • 闭角型青光眼:使用抗抑郁药治疗且未经治疗的解剖学窄角患者可能会发生闭角型青光眼。(5.6) • 头晕:AUVELITY 可能导致头晕。采取预防措施减少跌倒,操作机器时要小心。 (5.7)• 血清素综合征:将 AUVELITY 与选择性血清素再摄取抑制剂 (SSRI) 或三环类抗抑郁药一起使用会增加风险。如果发生,请停止使用。(5.8、7.1)• 胚胎-胎儿毒性:可能对胎儿造成伤害。告知孕妇胎儿的潜在风险。停止对孕妇进行治疗,并对计划怀孕的女性使用替代疗法。(5.9、8.1、8.3)
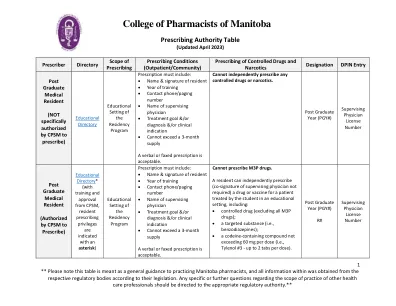
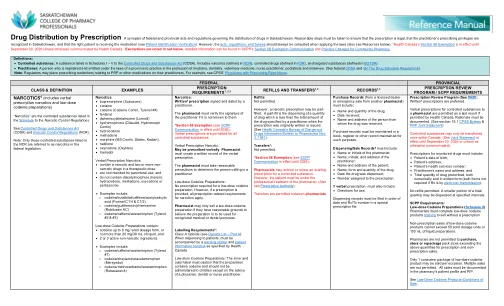
按处方分配药物
麻醉剂:由执业医师签名并注明日期的书面处方。如果药剂师不知道执业医师的签名,则必须核实。 *第 56 条豁免(参见 SCPP 通讯,有效期至 2026 年):所有管制物质都允许口头处方。口头处方麻醉剂:可以口头开具处方。药剂师必须创建口头处方的书面记录。药剂师必须采取合理的预防措施确定打电话的人是否是执业医师。低剂量可待因制剂:低剂量可待因制剂不需要处方。但是,如果提供了处方,则适用所有与麻醉剂处方相关的要求。药剂师只有在有合理理由相信低剂量可待因制剂将用于公认的医疗或牙科目的时才可以销售该制剂。标签要求 6:A 类阿片类药物(参见阿片类药物清单 - A 部分):在分发给患者时,必须附上加拿大卫生部规定的警告标签和患者信息手册。低剂量可待因制剂:内标签和外标签必须警告该制剂含有可待因,除非在医生、牙医或执业护士的建议下,否则不得给儿童服用。
灾难的处方 - 索引 /
CrimethInc.前工人集体支持或参与本文描述的任何愚蠢和危险的活动。作为资本主义邪恶的中产阶级受益者,我们没有动机去质疑保证我们言论特权的结构,我们也从来没有这样做过——只要问问我们的同事就知道了。这些页面中使用的“我们”是无政府主义者:它指的是所有那些从反权威抵抗的社会连续体中采取行动的人,并不一定指任何与这项工作相关的编辑、贡献者或追随者。我们忙于利用他人的叛乱,即使我们想参与,我们也没有时间参与——说真的,警官!
配方和处方指南
Z-药被认为对欧米茄1-苯二氮卓受体具有更大的选择性(导致较小的抗焦虑,抗惊厥药和肌肉松弛效应,据称对依赖性和耐受性的潜力较低)。此外,据报道,由于上述(相对于BDZS)受体选择性7,Zopiclone不会在中断时引起REM反弹。Zopiclone的活动发作为30-45分钟,作用持续时间被引用为“短”(或6小时2)。它是由CYP3A4系统代谢的,因此与抑制剂(如红霉素)相互作用。替代epam是一种非选择性的苯二氮卓类药物,因此除了催眠作用外,还具有一些抗焦虑(和肌肉 - 省X线)活性。它具有活动的中间持续时间(8-10小时),作用发作约1小时。它与慢性给药中的氟拉西m或硝基氮蛋白酶的积累程度无关。它没有在肝脏中氧化(与之共轭并排泄),因此不会与其他肝癌代谢药物竞争8-10。
处方信息的亮点
n(%)血液和淋巴系统疾病 - - 高热中性粒细胞减少A 49(73%)49(73%)心脏病 - - - - 心动过速B 10(15%)0眼疾 - - 视力模糊7(10%)0胃部疾病 - 胃部疾病 - mucosea -mucose c#62%51%(92%)34%(92%)(56)(92%) 17(25%)呕吐51(76%)12(18%)腹痛D 30(45%)2(3%)便秘28(42%)0腹泻19(28%)1(1%)一般疾病和给药地点条件 - - Pyrexia 24(36%)3(36%)3(4%)3(4%)3(4%)3(4%)3(4%),中毒,及时的复杂性e,3(3(3(3))营养障碍 - - 食欲降低43(64%)27(40%)神经系统疾病 - - 头痛19(28%)0焦虑f#10(15%)0呼吸道,胸腔和纵隔疾病 - epistaxis 13(Epistaxis 13(19%)5(19%)5(19%)5(7%)口交g#12(18%)3(18%)3(18%)3(4%)0(4%)cock 7(4%)cock 7(4%)cough 7(4%)cough 7(4%)cough 7(4%)疾病 - - 脱发48(72%)1(1%)皮疹H 14(21%)0瘙痒I#13(19%)0皮肤色素沉重化12(18%)0血管疾病 - - 高血压8(12%)1(1%) *包括与条件相关的不良事件。高热中性粒细胞减少症包括发热的骨髓性植物和热中性粒细胞减少症。b心动过速包括窦性心动过速和心动过速。c粘膜炎包括肛门炎症,结肠炎,胃肠道炎症,粘膜炎症,肠炎和气孔炎。d腹痛包括腹部不适,腹痛和腹痛上部。e输血反应包括过敏输血反应和过敏反输血反应。f焦虑包括akathisia,躁动,焦虑和烦躁。h皮疹包括皮疹,皮疹红斑,皮疹麦克鲁帕皮和荨麻疹。g口咽疼痛包括口腔溃疡,口腔疼痛和口咽疼痛。瘙痒包括肛门瘙痒,瘙痒和瘙痒过敏。#包括多个系统器官类。
处方信息的重点这些...
处方者必须注册REMS。处方者必须就封装细菌引起的严重感染风险咨询患者。处方者必须为患者提供REMS教育材料。处方者必须评估疫苗对封装细菌的疫苗接种状况,并根据需要在Voydeya首次剂量之前的两周前根据当前的ACIP建议进行疫苗接种。开处方者必须为抗菌药物预防的处方,如果必须紧急开始治疗,并且根据目前的ACIP建议,至少在Voydeya首次剂量之前的两周前,患者不采用针对封装细菌的疫苗进行疫苗的最新情况。必须在Voydeya rems中获得Voydeya的药房,并且必须验证处方者已获得认证。患者必须从处方者那里获得有关需要接受针对封装细菌建议的疫苗接种的咨询,需要按照处方者指示服用抗生素,以及严重感染的早期体征和症状。必须指示患者在治疗期间始终随身携带患者安全卡,并在最后剂量的Voydeya剂量后1周。
处方信息的亮点
警告:针对淀粉样蛋白相关的成像异常,针对β-淀粉样蛋白淀粉样蛋白的聚合形式的单克隆抗体,包括Kisunla,可以引起与淀粉样蛋白相关的成像异常(ARIA),其特征在于具有水肿(ARIA-E)的ARIA,含有含有血液(ARIA-E)的ARIA和含有Hymosiderin rysiderin reposition(Aria-H)的Aria。ARIA的发病率和时间之间有所不同。ARIA通常在治疗早期发生,通常是无症状的,尽管很少发生严重和威胁生命的事件。严重的脑出血> 1厘米,其中一些是致命的,在接受此类药物治疗的患者中。因为ARIA-E会导致可能模仿缺血性中风的局灶性神经系统缺陷,因此治疗临床医生应考虑在接受Kisunla治疗的患者进行溶栓治疗之前是否可能是由于ARIA-E引起的[请参见警告和预防措施(5.1),不良反应(6.1)。