XiaoMi-AI文件搜索系统
World File Search System纳米孔测序评估环境样品中细菌病原体和相关抗生素抗性基因
摘要:如前和现在的大流行中,监测环境中的病原体可以提供多种见解,以了解其传播,进化甚至将来的爆发。本文通过在罗马尼亚的市政水和废水中使用纳米孔测序,评估了与特定病原体相关的检测微生物病原体和相关抗生素耐药基因的机会。主要结果表明,从肉类加工设施中收集EF流动的水具有改变社区的多样性和丰度,Chao1的价值(101-108和0.86-0.91)分别降低了,分别是MAIN 2与其他类型的较高的多样性相比,分别是MAINIP的多样性,分别是Simpson的多样性和较高的多样性。和0.97–0.98,伯克霍尔德西亚和伪科学是最丰富的家庭。此外,抗生素耐药性基因的发生率和类型受到抗生素源的近端的影响,其四环素(最高为45%的总读数)或新霉素,链霉素和抗肉霉素(Traptomycin和tobramycin)(总读数为3.8%)(总读数)的耐药性(最高为reads reads)由Same condiestion condivession形成。因此,纳米孔测序被证明是一种易于使用的,可访问的分子技术,用于环境病原体监测和相关的抗生素耐药基因。
Twinrix 成人,INN-甲型肝炎(灭活)和乙型肝炎(rDNA)(HAB)疫苗(吸附)
疫苗中可能含有制造过程中使用的微量新霉素(见第 4.3 节)。有关辅料的完整列表,请参阅第 6.1 节。 3. 剂型 注射用混悬液 不透明白色混悬液 4. 临床特点 4.1 治疗指征 Twinrix 成人版适用于无免疫力的成人和 16 岁以上有感染甲型肝炎病毒和乙型肝炎病毒风险的青少年。 4.2 用法用量 用法用量 对于 16 岁及以上的成人和青少年,建议剂量为 1.0 毫升。 - 基本免疫接种时间表 成人Twinrix疫苗的标准基本免疫接种包括三剂:第一剂在选定的免疫接种日接种,第二剂在第一次免疫接种后1个月接种,第三剂在第一次免疫接种后6个月接种。在特殊情况下,当预计在接种第一剂疫苗后一个月或更长时间进行旅行且没有足够时间遵循标准(0、1、6)疫苗接种时间表时,成人可以采用在第 0、7 和 21 天进行三次连续肌肉注射的时间表。使用此疫苗接种时间表时,建议在第一剂疫苗接种 12 个月后接种第 4 剂疫苗。
麻疹、腮腺炎和风疹病毒疫苗
4.1 超敏反应 有对疫苗任何成分(包括明胶){3} 超敏反应史或在接种过一剂 MMR II 疫苗或任何其他含麻疹、腮腺炎和风疹疫苗后出现超敏反应史的个人请勿接种 MMR II 疫苗。 有对新霉素过敏史的个人请勿接种 MMR II 疫苗 [见说明 (11)]。 4.2 免疫抑制 请勿给因疾病或药物治疗而免疫缺陷或免疫抑制的个人接种 MMR II 疫苗。 据报道,免疫功能低下的个体无意中接种了含麻疹疫苗的疫苗,可直接导致麻疹包涵体脑炎 {4} (MIBE)、肺炎 {5} 和死亡。 在这一人群中,还曾报道过播散性腮腺炎和风疹疫苗病毒感染。 4.3 中度或重度发热性疾病 请勿给患有活动性发热性疾病(发热温度 > 101.3°F (> 38.5°C))的个人接种 MMR II 疫苗。 4.4 活动性未经治疗的结核病 请勿给患有活动性未经治疗的结核病 (TB) 的个人接种 MMR II 疫苗。 4.5 怀孕 请勿给怀孕或计划在下个月怀孕的个人接种 MMR II(见特定人群的使用(8.1)和患者咨询信息(17))。
来自苏格兰牛乳腺炎病例的克雷伯氏菌肺炎分离株的抗菌耐药性和分子流行病学
肺炎克雷伯氏菌是机会性病原体,可能导致奶牛乳腺炎。K.肺炎乳腺炎通常的治愈率较差,并且可能导致慢性感染的发展,这对健康和生产都有影响。但是,很少有研究旨在通过牛乳腺炎病例进行全基因组测序来充分表征肺炎。在这里,使用基质辅助激光解吸/电离飞行时间质谱(MALDI-TOF MS)和全基因组测序鉴定出与乳腺炎相关的肺炎分离株与乳腺炎相关的肺炎。此外,全基因组序列数据用于遗传分析,并且都与表型AMR测试并行,均与virulenceandantimicrobial耐药性(AMR)预测。四十二个分离株被鉴定为K.肺炎。进行全基因组测序,观察到31种多层次序列类型,这表明这些分离株的来源可能是环境的。分离株的关键毒力决定因素,编码了获得的铁载体,结肠癌和高胶体。其中大多数是缺乏的,除了YBST(编码Yersiniabactin)以六个分离株存在。在整个数据集中,对链霉素(26.2%)和四环素(19%)的表型AMR水平很明显,以及对头孢霉素(26.2%)和新霉素(21.4%)的中间易感性。的重要性是检测两个产生ESBL的分离株,这些分离株表现出对阿莫西林 - 克拉维酸,链霉素,四环素,头孢霉素,头孢菌素,头孢霉素和头孢菌素的抗性性。
不同浓度抗PD-1和抗PD-L1抗体对非小细胞肺癌患者免疫系统细胞活性的影响
将 PBMC 和支气管抽吸物部分放入三块 6 孔板中,在 37°C 和 5% CO 2 条件下培养 24 小时,培养液为 RPMI 1640 培养基(PAA Laboratories,美国),培养基中添加抗生素(1% 青霉素-链霉素-新霉素,Sigma Aldrich,美国),培养液为不同浓度的 nivolum-ab(5 µg/mL、10 µg/mL、20 µg/mL 培养物)(Bristol-Myers Squibb,美国)或 atezolizumab(150 µg/mL、300 µg/mL、600 µg/mL 培养物)(Roche,法国)。培养方法如图 1 所示。培养完成当天,从培养孔中回收细胞,并进行免疫表型分析。将外周血和支气管抽吸物中不用于培养的对照细胞分装到流式细胞仪管中,与一组单克隆抗体在 4°C 下孵育 30 分钟。然后用不含 Ca 2+ 和 Mg 2+ 离子的 PBS 缓冲液(离心参数:2000 rpm/5 分钟)洗去未结合抗体的残留物,并在流式细胞仪中对细胞免疫表型进行详细分析。反过来,将用单独的抗PD-1或抗PD-L1抗体进行短期培养的细胞在孵育24小时后,与结合有适当荧光染料的选定抗体(抗CD4-FITC、抗CD274-FITC、抗CD14-FITC、抗CD8-PE、抗CD14-PE、抗CD25-APC、抗CD69-APC、抗CD95-APC、抗CD279-APC(Becton Dickinson,美国))孵育。
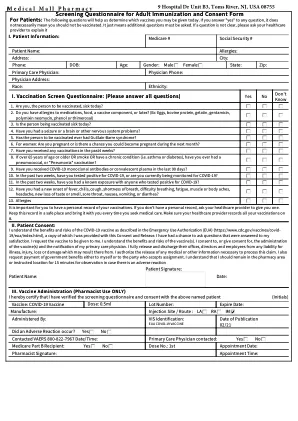
筛查成人免疫和患者同意书的问卷:以下问题将有助于我们确定您可能是哪种疫苗
患者姓名:过敏:地址:城市:DOB:年龄:性别:男女状态:邮政局:初级保健医生:医师电话:医师地址:种族:种族:I. I.疫苗接种屏幕问卷:(请回答所有问题)您是今天要接种疫苗的人吗?2。您对药物,食物,疫苗成分或乳胶有过敏吗?(例如:鸡蛋,牛蛋白,明胶,庆大霉素,多晶醛新霉素,苯酚或硫镁)3。今天正在接种病人的人吗?4。您是否有癫痫发作,大脑或其他神经系统问题?5。接种疫苗的人是否有Guillain-Barre综合征?6。女性:您怀孕还是有可能在下个月怀孕?7。过去4周内您是否接受过任何疫苗接种?8。如果超过65岁或以上或烟或慢性病(即哮喘或糖尿病),您是否曾接受过肺炎球菌或“肺炎”疫苗接种?9。您是否在过去的90天内收到了COVID-19-19S单克隆抗体或疗养等离子体?10。在过去的两个星期中,您是否对COVID-19的测试呈阳性,还是目前正在监视Covid-19?11。在过去的两个星期中,您是否与对Covid-19的阳性测试的任何人进行了已知接触?12。13。过敏您是否有新的发烧,发冷,咳嗽,呼吸急促,呼吸困难,疲劳,肌肉或身体酸痛,头痛,味觉或气味的新丧失,喉咙痛,恶心,呕吐或腹泻?
肯塔基大学疫苗接种同意书和处方 患者姓名: 社会保障号码: 医疗状况:
所有疫苗 — 如有任何问题,请咨询您的药剂师 是 否 如果回答请解释 是 您今天生病了吗?发烧、出皮疹或带状疱疹了吗?您是否对任何药物、食物(例如鸡蛋)、乳胶或任何疫苗成分(例如新霉素、甲醛、庆大霉素、硫柳汞、牛蛋白、苯酚、多粘菌素、明胶、面包酵母或酵母)过敏?您在接种疫苗后是否曾出现过严重反应?您以前接种过今天接种的疫苗吗? 疫苗/日期 您在过去 4 周内是否接种过任何疫苗或进行过皮肤测试?您是否曾癫痫发作、格林-巴利综合征 (GBS) 或任何神经或脑部疾病?您是否怀孕、哺乳或计划在未来三个月内怀孕?您是否吸烟、患有糖尿病、酗酒或免疫系统低下、脑脊液漏或人工耳蜗、慢性心脏病、肝病或肺病。(针对肺炎疫苗)您是否患有 HIV/AIDS、器官移植或骨髓移植、癌症、白血病、淋巴瘤、多发性硬化症、造血干细胞或任何其他免疫系统问题?活疫苗:Zostavax、MMR、LAIV、水痘您是否正在服用任何削弱免疫系统的药物?举几个例子:类固醇(如可的松、泼尼松)、硫唑嘌呤、6-巯基嘌呤、甲氨蝶呤、癌症或放射治疗、移植药物、类风湿性关节炎治疗、克罗恩病或牛皮癣。在过去的一年里,您是否接受过血液或血液制品(包括血浆/血小板制品)的输血,或者注射过抗病毒药物或免疫(丙种)球蛋白?您有血小板减少症或血小板减少性紫癜病史吗?(针对 MMR II)
MMR 疫苗可在初级保健机构中安全地为所有对鸡蛋过敏的儿童接种 1
背景 麻疹 麻疹仍然是可预防婴儿死亡的主要原因。它是一种病毒感染,可并发肺炎或脑炎等严重感染。 2 腮腺炎 腮腺炎是一种经常影响神经系统的病毒感染。 3 它是感音神经性听力损失的主要原因,还可引起睾丸炎、卵巢炎和脑炎,25% 的患者会留下永久性后遗症。 4 风疹 风疹是一种轻微的疾病。然而,孕早期母亲感染风疹可导致胎儿流产;婴儿可能患有先天性风疹综合症,该综合症会导致因耳聋、白内障、心脏缺陷和学习困难而终身残疾。 5 好处 麻疹、腮腺炎和风疹 (MMR) 疫苗是一种减毒活病毒疫苗,可刺激免疫系统而不会引起实际感染。该疫苗分两剂接种。该疫苗对麻疹和风疹的有效率约为 99%,对腮腺炎的有效率约为 88%。由于麻疹和腮腺炎疫苗是使用鸡胚成纤维细胞生产的,有人担心对鸡蛋过敏的儿童可能会出现过敏反应。然而,该疫苗仅含有微量的鸡蛋蛋白(pg - 1ng),不足以引起过敏反应。6 在三项对 1000 多名鸡蛋过敏患者的大型研究中,接种 MMR 疫苗后未报告任何严重反应。7,8,9,10 风险虽然 MMR 非常安全,但与其他疫苗一样,可能会发生不良反应。第一次注射后,可能会在免疫一周左右出现发烧和/或皮疹,并持续两到三天。第二次注射后不良反应的发生率要低得多。11 MMR 后的过敏反应极为罕见。12 对 MMR 疫苗本身的过敏可能是由明胶和新霉素等其他成分引起的。 13,14,15
Aflunov,INN-人畜共患流感疫苗(h5n1)(表面抗原,灭活,佐剂)
1. 药品名称 AFLUNOV 预充式注射器注射用混悬液。人畜共患流感疫苗(H5N1)(表面抗原,灭活,佐剂)。 2. 定性和定量成分 流感病毒表面抗原(血凝素和神经氨酸酶)* 菌株:A/turkey/Turkey/1/2005 (H5N1) 样菌株 (NIBRG-23)(进化枝 2.2.1) 每 0.5 毫升剂量 7.5 微克** * 在健康鸡群的受精鸡蛋中繁殖 ** 以微克血凝素表示。佐剂 MF59C.1 包含: 角鲨烯 每 0.5 ml 9.75 毫克 聚山梨醇酯 80 每 0.5 ml 1.175 毫克 山梨醇三油酸酯 每 0.5 ml 1.175 毫克 已知效果的赋形剂: 每 0.5 ml 剂量疫苗含有 1.899 毫克钠和 0.081 毫克钾。 AFLUNOV 可能含有制造过程中使用的鸡蛋和鸡蛋白、卵清蛋白、卡那霉素、硫酸新霉素、甲醛和十六烷基三甲基溴化铵的微量残留物(见第 4.3 节)。 有关赋形剂的完整列表,请参阅第 6.1 节。 3. 药物形式 预充注射器中的注射用混悬液。 乳白色液体。 4. 临床特点 4.1 治疗指征 针对甲型流感病毒 H5N1 亚型的主动免疫。该指征基于 18 岁及以上健康受试者在接种两剂含有 A/turkey/Turkey/1/2005 (H5N1) 类毒株的疫苗后获得的免疫原性数据(参见 4.4 和 5.1 节)。AFLUNOV 应按照官方建议使用。 4.2 剂量和给药方法 剂量 成人和老年人(18 岁及以上):在选定日期接种一剂 0.5 毫升。应在至少间隔 3 周后接种第二剂 0.5 毫升。
人畜共患流感疫苗 Seqirus,INN-人畜共患流感疫苗 (h5n8)(表面抗原,灭活,佐剂)
1. 药品名称 人畜共患流感疫苗 Seqirus 预充注射器注射悬浮液 人畜共患流感疫苗 (H5N8)(表面抗原,灭活,佐剂) 2. 定性和定量组成 流感病毒表面抗原(血凝素和神经氨酸酶)* 来自谱系:A/Astrakhan/3212/2020 N8 型菌株 (CBER-RG8A)(进化枝 2.3.4.4b) 每 0.5 毫升剂量 7.5 微克** * 在健康鸡群的受精鸡蛋中繁殖 ** 以血凝素 (HA) 微克表示。佐剂MF59C.1每0.5ml剂量含:角鲨烯(9.75mg)、聚山梨醇酯80(1.175mg)、山梨醇三油酸酯(1.175mg)、柠檬酸钠(0.66mg)和柠檬酸(0.04mg)。人畜共患流感疫苗 Seqirus 可能含有微量的鸡蛋和鸡蛋白、卵清蛋白、卡那霉素、硫酸新霉素、甲醛、氢化可的松和十六烷基三甲基溴化铵,这些物质在制造过程中使用(见 4.3 节)。有关辅料的完整列表,请参阅第 6.1 节。 3. 药物剂型 注射混悬液(注射剂)。疫苗是乳白色的液体。 4. 临床信息 4.1 治疗指征 人畜共患流感疫苗 Seqirus H5N8 适用于 18 岁及以上的成年人对 H5 亚型甲型流感病毒进行主动免疫(见 4.4 和 5.1 节)。该疫苗的使用必须符合官方建议。 4.2 用法用量 用法用量 成人和老年人(18 岁及以上):人畜共患流感疫苗 Seqirus H5N8 以肌肉注射方式给药,每剂 0.5 毫升,共 2 剂。第二剂应在第一剂给药三周后给药。儿童人群人畜共患流感疫苗 Seqirus H5N8 对 18 岁以下个体的安全性和有效性尚未确定。