XiaoMi-AI文件搜索系统
World File Search SystemCOVID-19 疫苗有效期及以后使用日期指南
COVID-19 疫苗的有效期可能延长,或者包装盒上可能标有生产日期。这使得包装盒或药瓶上显示的日期无法作为可靠的文件参考。此外,mRNA COVID-19 疫苗(Moderna 和 Pfizer)在从永久储存处移出到冰箱后,有一个使用期限 (BUD)。这两个日期的交叉可能会引起人们对疫苗有效性的不必要担忧。
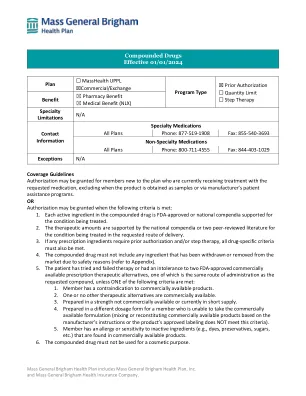
复合药物有效期 2024 年 1 月 1 日
1. 复方药物中的每种活性成分均经过 FDA 批准或得到国家药典的支持,可用于所治疗的疾病。 2. 治疗量得到国家药典或两份同行评审文献的支持,适用于所治疗疾病并采用所申请的给药途径。 3. 如果任何处方成分需要事先授权和/或分步治疗,则还必须满足所有特定于药物的标准。 4. 复方药物不得包含任何因安全原因已撤回或从市场上撤出的成分(参见附录)。 5. 患者尝试过两种 FDA 批准的市售处方治疗替代品但治疗失败或不耐受,其中一种与所申请的复方药物的给药途径相同,除非满足以下标准之一:
中央和东北威斯康星州 - 有效期2024年2月12日
●令人惊讶的是,截至2月11日,该地区的大部分地区几乎没有积雪。由于缺乏积雪并且低于正常降水量,在这个春季沿着河流浮游的风险很低,除非我们得到急需的雨水和雪。密歇根湖比去年下降了约6英寸。
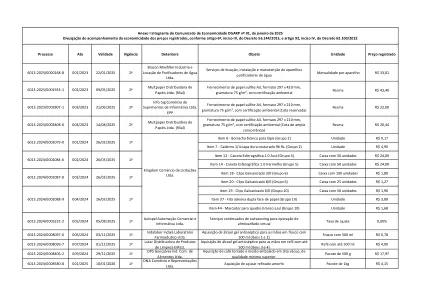
流程 分钟 有效期 期限 持有人 对象 单位 注册价格
附件一,DGARP 经济通知第 01 号(2025 年 1 月)的一部分,根据第 56.144/2015 号法令第 6 条第 IV 款和第 62.100/2022 号法令第 92 条第 IV 款披露注册价格经济监测情况
中央和东北威斯康星州 - 有效期4月29日,2024年4月29日
●该产品将在2024年6月1日之前更新,或者如果干旱状况发生重大变化,则将更早。●请参阅https://drought.gov/dreghtch-information-Statements上的所有当前可用产品。●请访问https://www.weather.gov/grb/drefforchinformationStatement,以获取以前的语句。
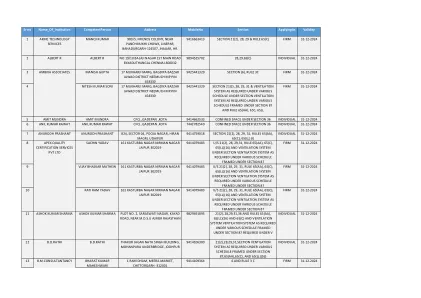
序号 机构名称 主管人员 地址 手机号码 申请科目 有效期
15 BALMUKUND BAL MUKUND CFCL ,GADEPAN ,KOTA 9785185386 密闭空间,第 36 条规定 个人 31-12-2024 16 BANWARI LAL RATHORE BANWARI LAL RATHORE BABANT VIHAR,KOTA 9950807244 进行此类测试、考试、检查和认证
Hayya 卡现在有效期至 2024 年 1 月 - 多哈 - 卡塔尔论坛报
和他的粉丝们一样,过去几天在印度电影院观看《Pathaan》就像是参加一个节日。人们兴奋地推挤着,为之疯狂,与亲朋好友一起欣赏这部电影,甚至在电影院里随着电影的热门歌曲跳舞。对于经历了一部又一部电影失败的宝莱坞观众和祝福者来说,《Pathaan》的辉煌历程是如此美好,让人感觉不真实。虽然这部电影在印度各地的多厅影院票房火爆,但它似乎也让单个影院起死回生——其中大多数影院在新冠疫情爆发后都关门了。毕竟,这位超级巨星时隔四年重返银幕并担任主角。沙鲁克汗与已故艺人拉兹卡普尔 (Raj Kapoor) 以及某种程度上米顿查克拉博蒂 (Mithun Chakraborty) 非常相似,拥有大量国际粉丝,包括海湾国家、欧洲、美国等。与沙鲁克汗在其他地方的粉丝一样,居住在卡塔尔的印度侨民似乎很喜欢《Pathaan》所带来的每一点电影体验。阿拉伯海莫道克大学卡塔尔校友会主席兼阿拉伯海莫道克大学校友司仪俱乐部创始主席 Jawed Ahmad 在分享他的评论时,愿意为《Pathaan》打 10 分!“这是一部充满动作、惊悚、悬疑和爱国主义的电影,总的来说,这是一部完整的娱乐作品。沙鲁克汗、迪皮卡、约翰、萨尔曼 [汗] 都以精湛的演技震撼人心。我们没有发现电影中有任何争议。经过很长一段时间,这是一部必看的电影,传达了多元化团结的强烈信息,”他告诉《卡塔尔论坛报》。另一位居住在多哈的印度侨民穆罕默德·穆萨拉夫·汗也表达了类似的看法。“我最近在电影院观看《Pathaan》的经历非常愉快。这是一部动作惊悚片,就动作片而言,这部电影绝对符合我的要求
强制性选修模块目录“大师土木工程”课程,有效期为2025年夏季学期
概述了土木工程硕士学位的强制性选修模块,以在“建筑 - 建筑和能源效率”,“建筑物 - 基础设施和运输”和“建筑和建筑项目管理中的数字方法”的主要区域中在当前有效的版本中规范SPO。
nr_jynneos loa添加BN解释有效期并在报告时间表上具有灵活性
2024年12月23日,约翰·贝格尔(John Beigel),医学博士微生物学和感染疾病临床研究部副主任国家过敏和传染病研究所(NIAID)亲爱的贝格尔博士:2022年8月9日,第564(b)(b)(1)(c)法案,该法案是卫生和公共服务部的强大(HHS),或者是一项重要的公共服务部门,或者是一项重要的公共服务(HHS),或者是一项重要的一项,或者是一项公共服务(HHS),或者是A的一项公共服务,或者是一项公共服务。居住在国外的美国公民(美国)公民的影响,国家安全或健康与安全的重要潜力,其中涉及Monkeypox病毒。根据这种决定,HHS秘书宣布,根据该法令第564条,授权紧急使用疫苗用于对Monkeypox病毒的授权是合理的,但要遵守该条款下颁发的任何授权条款。1,2022年8月9日,根据该法第564条。the FDA issued an EUA for the emergency use of Jynneos to prevent monkeypox infection in 1) individuals less than 18 years of age determined to be at high risk of monkeypox infection when two 0.5 mL doses are administered subcutaneously 4 weeks apart, and individuals 18 years of age and older determined to be at high risk of monkeypox infection when two 0.1 mL doses are administered intradermally 4 weeks apart.s ub随后在2022年8月16日进行了审查,以支持延长jynneos批次的持有时间,以使疫苗在解冻后将疫苗储存在2-8C,持续8周。在2024年12月23日得出结论,根据该法案第564(g)(2)条的规定,修订本EUA适合保护公共卫生或安全,FDA正在重新发行2022年8月9日的全部授权书,并修订为:1),以消除易于何种措施的要求,以消除易用的策略(以供应)限制了(限制)(供应量)(解冻后,某些大量的jynneos疫苗保持在 +2°C至 +8°C( +36°F至 +46°F); 3)修改条件J,以提供灵活性,以确定适当的定期安全报告的不同报告间隔。
延长 JYNNEOS(天花和猴痘活疫苗,非复制型)的有效期
本函旨在通知您 JYNNEOS®(天花和猴痘活疫苗,非复制型)FDP00017、FDP00018、FDP00019、FDP00020 批次的有效期将延长。四批 JYNNEOS®(FDP00017、FDP00018、FDP00019 和 FDP00020)的纸箱标签上印刷的有效期为 2024 年 10 月 31 日,储存温度为 -25°C 至 -15°C(-13°F 至 +5°F)。这些批次的有效期已延长至 2026 年 8 月 31 日,储存温度为 -25°C 至 -15°C(-13°F 至 +5°F)。