XiaoMi-AI文件搜索系统
World File Search System使用量子计算机进行蛋白质折叠
半个多世纪以来,蛋白质折叠一直是最困难的问题之一,随机热运动导致构象变化,从而导致能量下降到天然结构,这是漏斗状能量景观中捕获的原理。未折叠的多肽具有广泛的可能构象。由于潜在构象随链长呈指数增长,搜索问题对于经典计算机来说变得难以解决。到目前为止,有理论和实验证据表明,使用量子退火、VQE 和 QAOA 等量子计算方法解决此类优化问题具有优势。虽然谷歌的 DeepMind-AlphaFold 已经取得了很大成就,但我们可以通过量子方法走得更远。在这里,我们展示了如何使用变分量子特征求解器预测蛋白质结构以及 RNA 折叠,并使用条件风险值 (CVaR) 期望值来解决问题并找到最小配置能量,我们的任务是确定蛋白质的最小能量结构。蛋白质的结构经过优化以降低能量。还要确保满足所有物理约束,并将蛋白质折叠问题编码为量子比特算子。
超分子支架定向二维...
二维分子组装体越来越受到人们的关注,而这种结构很难仅依靠自发分子组装来构建。本文我们展示了使用三足三蝶烯超分子支架实现的并苯发色团的二维组装体,这种支架已被证明具有强大的二维分子和聚合物基序组装能力。我们设计了夹在两个三足三蝶烯单元之间的并五苯和蒽衍生物。这些化合物组装成预期的二维结构,并五苯发色团既有足够的重叠以引起单线态裂变,又有足够的构象变化空间以促进三线态对解离成两个自由三线态,而蒽类似物则并非如此。详细的光谱分析表明,组装体中的并五苯发色团以高量子产率(ΦSF=88±5%)发生单线态裂变,产生三线态对,从中可得到自由三线态
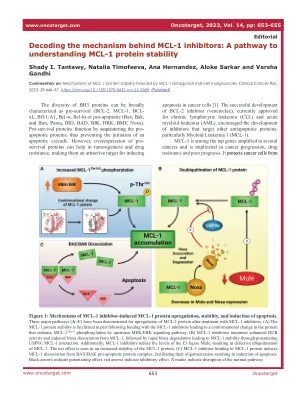
了解 MCL-1 蛋白质稳定性的途径
图 1:MCL-1 抑制剂诱导的 MCL-1 蛋白上调、稳定性和诱导细胞凋亡的机制。已证实使用 MCL-1 抑制剂治疗后,MCL-1 蛋白有三种主要上调途径 (A – C)。 (A) MCL-1 蛋白稳定性在一定程度上是在与 MCL-1 抑制剂结合后得到促进的,导致蛋白质构象变化,从而通过上游 MEK/ERK 信号通路增强 MCL-1 Thr163 磷酸化。 (B) MCL-1 抑制剂治疗增强了 DUB 活性并诱导 Noxa 与 MCL-1 解离,随后 Noxa 快速降解,通过增强 USP9x:MCL-1 相互作用实现 MCL-1 稳定性。此外,MCL-1 抑制剂降低了 E3 连接酶 Mule 的水平,导致 MCL-1 泛素化缺陷。净效应表现为 MCL-1 蛋白稳定性增加。 (C) MCL-1 抑制剂与 MCL-1 蛋白结合,诱导 MCL-1 与 BAX/BAK 促凋亡蛋白复合物分离,促进其寡聚化,从而诱导细胞凋亡。黑色箭头表示增强作用,红色箭头表示抑制作用。X 标记表示正常通路中断。
对MCM8/9 Helicase Complex>的结构和机械见解
摘要MCM8和MCM9形成了一种功能性解旋酶复合物(MCM8/9),该复合酶在DNA同源重组修复中起着DNA双链断裂的作用。但是,DNA结合/放松的MCM8/9的结构表征尚不清楚。在这里,我们使用冷冻电子显微镜单粒子分析报告了MCM8/9复合物的结构。结构表明,MCM8/9通过三倍的对称轴排列到异己盒中,从而形成一个可容纳DNA的中央通道。MCM8/9的N-最小寡糖/寡核苷酸(OB)结构域的多种特征发夹突出进入中心通道,并放松双链DNA。被HROB激活时,MCM8/9的N层环的结构将其对称性从C3转换为C1,并通过扩展MCM8/9的Trimer界面的构象变化。此外,我们的结构动态分析表明,柔性C-Tier环相对于N层环表现出旋转运动,这是MCM8/9的放松能力所必需的。总而言之,我们的结构和生物化学研究为理解同源重组中MCM8/9解旋酶的DNA解体机制提供了基础。
三萜衍生物作为SARS-COV-2的RBD尖峰蛋白的潜在抑制剂:一种硅方法
摘要:2019年新的冠状病毒SARS-COV-2的出现启动了国际公共卫生紧急情况。尽管疫苗接种的迅速进展减少了死亡人数,但仍需要替代治疗以克服该疾病的疗法。众所周知,感染始于峰值糖蛋白(病毒表面)和血管紧张素转化酶2细胞受体(ACE2)的相互作用。因此,促进病毒抑制的直接解决方案似乎是寻找能够废除这种附着的分子。在这项工作中,我们通过分子对接和分子动力学仿真,测试了18种三萜衍生物作为SARS-COV-2对SARS-COV-2对受体结合结构域(RBD)的潜在抑制剂,从而对RBD-ace2 Complex2 Complect2 Complexs2 Complect的X射线结构进行了建模RBD S1亚基。分子对接表明,每种类型的至少三个三萜衍生物(即少氨酸,草皮和ursolic)具有与参考分子相似的相互作用能,即糖酸。分子动力学表明,来自丁香酸和ursolic酸OA5和UA2的两种化合物可以诱导能够破坏RBD-ACE2相互作用的构象变化。最后,物理化学和药代动力学特性模拟显示出有利的生物学活性作为抗病毒药。
kirkpatrick2020-lockr-crispr。 ...
摘要:要在基因组内特定位点的空间控制生化功能,我们设计了一种合成开关,该开关在绑定到其DNA目标位点时激活。该系统使用两个CRISPR - CAS配合物将从头设计的蛋白质开关(Co -Lockr)的组件共定位到基因组中的相邻位点。共定位触发了从无活动的封闭状态到具有裸露功能性肽的活动开放状态的开关中的构象变化。我们在酵母中原型制作系统,并证明DNA结合触发了开关的激活,转录因子的募集以及下游报告基因的表达。这个由DNA触发的共洛克雷开关提供了一个平台,为工程师复杂的功能提供了一个平台,该平台只能在基因组内的特定目标位点执行,并具有在包括表观遗传调节,成像,成像和遗传逻辑通心素在内的广泛合成系统中的潜在应用。关键字:CRISPR- CAS,COS-LOCKR,蛋白质开关,遗传回路
用于分子和细胞操纵的分裂蛋白电磁激活的推定设计
使用外部刺激来操纵细胞功能的能力是研究复杂生物学现象的有力策略。调节细胞环境功能的一种方法是分裂蛋白。在这种方法中,生物活性蛋白或酶是碎片的,因此仅在特定刺激下重新组装。尽管有许多工具可诱导这些系统,但自然已经提供了扩展分裂蛋白质工具箱的其他机制。在这里,我们展示了一种使用磁刺激来重构分裂蛋白的新方法。我们发现电磁感知基因(EPG)因磁场刺激而改变构象。通过将某个蛋白质的分裂片段融合到EPG的两个末端,可以将片段重新组合成由于构象变化而引起的磁刺激的功能蛋白。我们用三种独立的分裂蛋白显示了这种作用:纳米核,APEX2和单纯疱疹病毒型1胸苷激酶。我们的结果首次表明,只有用磁场才能实现分裂蛋白的重建。我们预计这项研究将是未来磁性诱导的分裂蛋白设计的起点,用于细胞扰动和操纵。通过这项技术,我们可以帮助扩展分裂蛋白质平台的工具箱,并可以更好地阐明复杂的生物系统。
柔性 DNA 折纸纳米致动器作为尺寸选择性纳米孔
生物纳米孔对控制生物分子跨细胞脂质膜的进出口至关重要。它们在生物物理学和生物技术领域得到广泛应用,其通常较窄且固定的直径能够选择性地运输离子和小分子,以及用于测序应用的 DNA 和肽。然而,由于其通道尺寸较小,因此无法通过较大的大分子,例如治疗剂。在这里,利用 DNA 折纸纳米技术、机器启发设计和合成生物学的独特组合特性,提出一种结构可重构的 DNA 折纸 MechanoPore (MP),其管腔可通过分子触发器调整大小。通过 3D-DNA-PAINT 超分辨率成像和染料流入分析证实了 MP 在 3 个稳定状态之间的可控切换,这是通过反相乳液 cDICE 技术在脂质体膜中重建大型 MP 后实现的。跨膜运输的共聚焦成像显示了具有可调阈值的尺寸选择性行为。重要的是,构象变化是完全可逆的,证明了强大的机械切换可以克服来自周围脂质分子的压力。这些 MP 推动了纳米孔技术的发展,提供了可以根据需要进行调整的功能性纳米结构,从而影响了药物输送、生物分子分选和传感以及自下而上的合成生物学等多种领域。
针对 S6K1 的化合物可阻碍脂肪量扩张并减轻饮食引起的肝脂肪变性
简介 肝脏和脂肪组织控制着体内脂质稳态。长期食用含有大量脂肪的饮食时,这些器官的相互功能障碍可能会加剧与肥胖相关的代谢紊乱 (1)。其中,血脂异常(包括高甘油三酯血症和高胆固醇血症)是肥胖相关代谢失衡的共同特征,可能引发一系列并发症,即所谓的代谢综合征 (2)。此外,肝脏脂肪变性是脂质稳态紊乱的关键致病因素,可加速动脉粥样硬化,并使血脂异常处于肥胖与心血管和代谢疾病风险的交汇点 (3–5)。因此,一种能降低脂肪量膨胀并改善肝脏脂质处理、预防肝脂肪变性和血脂异常的药理学化合物将为治疗与肥胖表型相关的代谢综合征带来重大进展。核糖体蛋白 S6 激酶 1 (S6K1) 在哺乳动物雷帕霉素靶蛋白复合物 1 (mTORC1) 下游起作用,后者控制对激素和有丝分裂原的反应,还协调细胞对营养物质和能量输入的反应 (6)。S6K1 的激活由一系列有序的构象变化和磷酸化步骤介导,其中 mTORC1 对 T389 的磷酸化为磷酸肌醇依赖性激酶 1 (PDK1) 创造了一个对接位点,从而允许 T229 磷酸化 (7)。
具有生成深度学习
遵循序列和结构旋转,预测实施生物学功能的蛋白质的动力学机制仍然是一个杰出的科学挑战。几种实验技术和分子动力学(MD)模拟原则上可以确定构象状态,结合构型及其概率,但吞吐量较低。在这里,我们开发了一种生物分子模拟器(BioEmu),这是一种生成深度学习系统,可以在单个图形处理单元上每小时从蛋白质结构集合中生成数千个独立的独立样品。通过利用新颖的培训方法和蛋白质结构的大量数据,超过200毫秒的MD模拟以及实验蛋白质稳定性,BioeMu的蛋白质集合代表了一系列具有挑战性且实际相关的指标的平衡。在定性上,生物EMU采样了许多与功能相关的构象变化,范围从隐性口袋的形成,到特定蛋白质区域的展开,到大型域的后方范围。定量地,生物EMU对蛋白质构象与1 kcal/mol左右的相对自由能误差进行了构象构象,以验证了毫秒timesscale MD模拟和实验测量的蛋白稳定性。通过同时模拟结构集合和热力学特性,生物EMU揭示了机械洞察力,例如突变体折叠不稳定的原因,并可以有效地提供实验性检验的假设。