XiaoMi-AI文件搜索系统
World File Search System30004AB1c3 一种提高切花和幼苗生产力的突破性产品……
我们将完善针对日本存在的两种镰刀菌引起的猝倒病的抗性DNA标记,并开发针对另一种镰刀菌引起的茎腐病的抗性DNA标记。这些 DNA 标记将用于开发潜在的抗性品种。 (独立行政法人农业食品综合研究机构、蔬菜花卉事业部、金子种子、长野县蔬菜花卉试验场、静冈县农林技术研究所、福冈县农林研究中心、资源利用研究中心、熊本县农业研究中心、农业园艺研究所) ② 开发有助于解决各产区课题的开创性品系
皮肤微生物组,皮肤健康与疾病
抽象的微生物组不仅存在于肠道中,还存在于口腔,鼻腔,呼吸道,生殖和尿路以及皮肤中。皮肤中的微生物组在整个皮肤中存在,尽管与肠道和口腔中的微生物组相比,每单位面积的细菌数量在10 5 /cm 2时较小。免疫学教科书指出,皮肤是防止外来物质和病原体从外部进行的障碍,并且皮肤微生物组充当生物障碍,但直到本世纪初,这几乎是一个谜,这几乎是一个谜,皮肤微生物组与人类健康和疾病之间的关系如何。随着下一代测序(NGS)分析的最新进展,已经揭示了皮肤微生物组的组成,以及皮肤稳态的维持与调节引起的各种皮肤疾病之间的关系逐渐变得明确。
儿童中的粪便菌群移植:系统评价
美国小儿胃肠病学,肝病学和营养学会以及欧洲小儿胃肠病学,肝病学和营养学会。J Pediatr胃肠道Nutr。2019; 68(1):130-43。 5。 Fareed S,Sarode N,Stewart FJ等。 应用粪便微生物群移植(FMT)来治疗儿童的艰难梭菌感染(RCDI)。 peerj。 2018; 6:E4663。 6。 Zhang XY,Wang YZ,Li XL等。 中国儿童中粪便菌群转移的安全性:一项单中心回顾性研究。 世界J临床病例。 2018; 6(16):1121-7。 7。 Quraishi MN,Widlak M,Bhala N等。 进行荟萃分析的系统审查:粪便菌群移植对复发和难治性艰难梭菌的治疗的功效。 Aliment Pharmacol Ther。 2017; 46(5):479-93。 8。 Brumbaugh de,de Zoeten EF,Pyo-Twist A等。 胃内粪便微生物群移植计划用于治疗儿童的艰难梭菌的相互作用梭状芽胞杆菌是有效的,安全的且不足的。 J Pediatr。 2018; 194:123-7。 9。 Hourigan SK,Ahn M,Gibson KM等。 粪便艰难梭菌儿童中的粪便移植可持续减少抗微症的耐药性和潜在的病原体负担。 开放论坛感染。 2019; 6(10):OFZ379。 doi:10.1093/ofid/ofz379 10。 Hourigan SK,Chen LA,Grigoryan Z等。 Aliment Pharmacol Ther。2019; 68(1):130-43。5。Fareed S,Sarode N,Stewart FJ等。应用粪便微生物群移植(FMT)来治疗儿童的艰难梭菌感染(RCDI)。peerj。2018; 6:E4663。 6。 Zhang XY,Wang YZ,Li XL等。 中国儿童中粪便菌群转移的安全性:一项单中心回顾性研究。 世界J临床病例。 2018; 6(16):1121-7。 7。 Quraishi MN,Widlak M,Bhala N等。 进行荟萃分析的系统审查:粪便菌群移植对复发和难治性艰难梭菌的治疗的功效。 Aliment Pharmacol Ther。 2017; 46(5):479-93。 8。 Brumbaugh de,de Zoeten EF,Pyo-Twist A等。 胃内粪便微生物群移植计划用于治疗儿童的艰难梭菌的相互作用梭状芽胞杆菌是有效的,安全的且不足的。 J Pediatr。 2018; 194:123-7。 9。 Hourigan SK,Ahn M,Gibson KM等。 粪便艰难梭菌儿童中的粪便移植可持续减少抗微症的耐药性和潜在的病原体负担。 开放论坛感染。 2019; 6(10):OFZ379。 doi:10.1093/ofid/ofz379 10。 Hourigan SK,Chen LA,Grigoryan Z等。 Aliment Pharmacol Ther。2018; 6:E4663。6。Zhang XY,Wang YZ,Li XL等。 中国儿童中粪便菌群转移的安全性:一项单中心回顾性研究。 世界J临床病例。 2018; 6(16):1121-7。 7。 Quraishi MN,Widlak M,Bhala N等。 进行荟萃分析的系统审查:粪便菌群移植对复发和难治性艰难梭菌的治疗的功效。 Aliment Pharmacol Ther。 2017; 46(5):479-93。 8。 Brumbaugh de,de Zoeten EF,Pyo-Twist A等。 胃内粪便微生物群移植计划用于治疗儿童的艰难梭菌的相互作用梭状芽胞杆菌是有效的,安全的且不足的。 J Pediatr。 2018; 194:123-7。 9。 Hourigan SK,Ahn M,Gibson KM等。 粪便艰难梭菌儿童中的粪便移植可持续减少抗微症的耐药性和潜在的病原体负担。 开放论坛感染。 2019; 6(10):OFZ379。 doi:10.1093/ofid/ofz379 10。 Hourigan SK,Chen LA,Grigoryan Z等。 Aliment Pharmacol Ther。Zhang XY,Wang YZ,Li XL等。中国儿童中粪便菌群转移的安全性:一项单中心回顾性研究。世界J临床病例。2018; 6(16):1121-7。 7。 Quraishi MN,Widlak M,Bhala N等。 进行荟萃分析的系统审查:粪便菌群移植对复发和难治性艰难梭菌的治疗的功效。 Aliment Pharmacol Ther。 2017; 46(5):479-93。 8。 Brumbaugh de,de Zoeten EF,Pyo-Twist A等。 胃内粪便微生物群移植计划用于治疗儿童的艰难梭菌的相互作用梭状芽胞杆菌是有效的,安全的且不足的。 J Pediatr。 2018; 194:123-7。 9。 Hourigan SK,Ahn M,Gibson KM等。 粪便艰难梭菌儿童中的粪便移植可持续减少抗微症的耐药性和潜在的病原体负担。 开放论坛感染。 2019; 6(10):OFZ379。 doi:10.1093/ofid/ofz379 10。 Hourigan SK,Chen LA,Grigoryan Z等。 Aliment Pharmacol Ther。2018; 6(16):1121-7。7。Quraishi MN,Widlak M,Bhala N等。 进行荟萃分析的系统审查:粪便菌群移植对复发和难治性艰难梭菌的治疗的功效。 Aliment Pharmacol Ther。 2017; 46(5):479-93。 8。 Brumbaugh de,de Zoeten EF,Pyo-Twist A等。 胃内粪便微生物群移植计划用于治疗儿童的艰难梭菌的相互作用梭状芽胞杆菌是有效的,安全的且不足的。 J Pediatr。 2018; 194:123-7。 9。 Hourigan SK,Ahn M,Gibson KM等。 粪便艰难梭菌儿童中的粪便移植可持续减少抗微症的耐药性和潜在的病原体负担。 开放论坛感染。 2019; 6(10):OFZ379。 doi:10.1093/ofid/ofz379 10。 Hourigan SK,Chen LA,Grigoryan Z等。 Aliment Pharmacol Ther。Quraishi MN,Widlak M,Bhala N等。进行荟萃分析的系统审查:粪便菌群移植对复发和难治性艰难梭菌的治疗的功效。Aliment Pharmacol Ther。2017; 46(5):479-93。 8。 Brumbaugh de,de Zoeten EF,Pyo-Twist A等。 胃内粪便微生物群移植计划用于治疗儿童的艰难梭菌的相互作用梭状芽胞杆菌是有效的,安全的且不足的。 J Pediatr。 2018; 194:123-7。 9。 Hourigan SK,Ahn M,Gibson KM等。 粪便艰难梭菌儿童中的粪便移植可持续减少抗微症的耐药性和潜在的病原体负担。 开放论坛感染。 2019; 6(10):OFZ379。 doi:10.1093/ofid/ofz379 10。 Hourigan SK,Chen LA,Grigoryan Z等。 Aliment Pharmacol Ther。2017; 46(5):479-93。8。Brumbaugh de,de Zoeten EF,Pyo-Twist A等。胃内粪便微生物群移植计划用于治疗儿童的艰难梭菌的相互作用梭状芽胞杆菌是有效的,安全的且不足的。J Pediatr。2018; 194:123-7。 9。 Hourigan SK,Ahn M,Gibson KM等。 粪便艰难梭菌儿童中的粪便移植可持续减少抗微症的耐药性和潜在的病原体负担。 开放论坛感染。 2019; 6(10):OFZ379。 doi:10.1093/ofid/ofz379 10。 Hourigan SK,Chen LA,Grigoryan Z等。 Aliment Pharmacol Ther。2018; 194:123-7。9。Hourigan SK,Ahn M,Gibson KM等。 粪便艰难梭菌儿童中的粪便移植可持续减少抗微症的耐药性和潜在的病原体负担。 开放论坛感染。 2019; 6(10):OFZ379。 doi:10.1093/ofid/ofz379 10。 Hourigan SK,Chen LA,Grigoryan Z等。 Aliment Pharmacol Ther。Hourigan SK,Ahn M,Gibson KM等。粪便艰难梭菌儿童中的粪便移植可持续减少抗微症的耐药性和潜在的病原体负担。开放论坛感染。2019; 6(10):OFZ379。 doi:10.1093/ofid/ofz379 10。 Hourigan SK,Chen LA,Grigoryan Z等。 Aliment Pharmacol Ther。2019; 6(10):OFZ379。doi:10.1093/ofid/ofz379 10。Hourigan SK,Chen LA,Grigoryan Z等。 Aliment Pharmacol Ther。Hourigan SK,Chen LA,Grigoryan Z等。Aliment Pharmacol Ther。微生物组的变化与患有和不发炎性肠病的儿童粪便微生物群移植后持续根除艰难梭菌有关。2015; 42(6):741-52。 11。 li X,Gao X,Hu H等。 粪便微生物群移植后的临床疗效和微生物组的变化在艰难梭菌感染的儿童中。 前微生物。 2018; 9:2622。 12。 Nicholson MR,Mitchell PD,Alexander E等。 粪便中的粪便对艰难梭菌感染的疗效。 临床胃肠道乙醇。 2020; 18(3):612-9。 13。 Barnes D,Ng K,Smits S,Sonnenburg J,Kassam Z,Park KT。 竞争性选择的供体粪便微生物群移植:作为供体质量的量度的浓度和多样性。 J Pediatr胃肠道Nutr。 2018; 67(2):185-7。 14。 Zeky N.艰难梭菌感染的儿科患者的住院和门诊粪便菌群移植。 实践胃肠道。 2020; 44(7):38-46。 15。 Drewes JL,Corona A,Sanchez U等。 在粪便微生物群移植期间,反复发作的梭状芽胞杆菌艰难梭菌的传播和明确的procarcinogic细菌。 JCI Insight。 2019; 4(19):E130848。 16。 Bluestone H,Kronman MP,Suskind DL。 粪便微生物群移植,用于小儿造成的He-Matopoietic干细胞移植受者的复发性梭状芽胞杆菌感染。 17。2015; 42(6):741-52。11。li X,Gao X,Hu H等。粪便微生物群移植后的临床疗效和微生物组的变化在艰难梭菌感染的儿童中。前微生物。2018; 9:2622。12。Nicholson MR,Mitchell PD,Alexander E等。 粪便中的粪便对艰难梭菌感染的疗效。 临床胃肠道乙醇。 2020; 18(3):612-9。 13。 Barnes D,Ng K,Smits S,Sonnenburg J,Kassam Z,Park KT。 竞争性选择的供体粪便微生物群移植:作为供体质量的量度的浓度和多样性。 J Pediatr胃肠道Nutr。 2018; 67(2):185-7。 14。 Zeky N.艰难梭菌感染的儿科患者的住院和门诊粪便菌群移植。 实践胃肠道。 2020; 44(7):38-46。 15。 Drewes JL,Corona A,Sanchez U等。 在粪便微生物群移植期间,反复发作的梭状芽胞杆菌艰难梭菌的传播和明确的procarcinogic细菌。 JCI Insight。 2019; 4(19):E130848。 16。 Bluestone H,Kronman MP,Suskind DL。 粪便微生物群移植,用于小儿造成的He-Matopoietic干细胞移植受者的复发性梭状芽胞杆菌感染。 17。Nicholson MR,Mitchell PD,Alexander E等。粪便中的粪便对艰难梭菌感染的疗效。临床胃肠道乙醇。2020; 18(3):612-9。13。Barnes D,Ng K,Smits S,Sonnenburg J,Kassam Z,Park KT。 竞争性选择的供体粪便微生物群移植:作为供体质量的量度的浓度和多样性。 J Pediatr胃肠道Nutr。 2018; 67(2):185-7。 14。 Zeky N.艰难梭菌感染的儿科患者的住院和门诊粪便菌群移植。 实践胃肠道。 2020; 44(7):38-46。 15。 Drewes JL,Corona A,Sanchez U等。 在粪便微生物群移植期间,反复发作的梭状芽胞杆菌艰难梭菌的传播和明确的procarcinogic细菌。 JCI Insight。 2019; 4(19):E130848。 16。 Bluestone H,Kronman MP,Suskind DL。 粪便微生物群移植,用于小儿造成的He-Matopoietic干细胞移植受者的复发性梭状芽胞杆菌感染。 17。Barnes D,Ng K,Smits S,Sonnenburg J,Kassam Z,Park KT。竞争性选择的供体粪便微生物群移植:作为供体质量的量度的浓度和多样性。J Pediatr胃肠道Nutr。2018; 67(2):185-7。 14。 Zeky N.艰难梭菌感染的儿科患者的住院和门诊粪便菌群移植。 实践胃肠道。 2020; 44(7):38-46。 15。 Drewes JL,Corona A,Sanchez U等。 在粪便微生物群移植期间,反复发作的梭状芽胞杆菌艰难梭菌的传播和明确的procarcinogic细菌。 JCI Insight。 2019; 4(19):E130848。 16。 Bluestone H,Kronman MP,Suskind DL。 粪便微生物群移植,用于小儿造成的He-Matopoietic干细胞移植受者的复发性梭状芽胞杆菌感染。 17。2018; 67(2):185-7。14。Zeky N.艰难梭菌感染的儿科患者的住院和门诊粪便菌群移植。实践胃肠道。2020; 44(7):38-46。15。Drewes JL,Corona A,Sanchez U等。在粪便微生物群移植期间,反复发作的梭状芽胞杆菌艰难梭菌的传播和明确的procarcinogic细菌。JCI Insight。 2019; 4(19):E130848。 16。 Bluestone H,Kronman MP,Suskind DL。 粪便微生物群移植,用于小儿造成的He-Matopoietic干细胞移植受者的复发性梭状芽胞杆菌感染。 17。JCI Insight。2019; 4(19):E130848。 16。 Bluestone H,Kronman MP,Suskind DL。 粪便微生物群移植,用于小儿造成的He-Matopoietic干细胞移植受者的复发性梭状芽胞杆菌感染。 17。2019; 4(19):E130848。16。Bluestone H,Kronman MP,Suskind DL。粪便微生物群移植,用于小儿造成的He-Matopoietic干细胞移植受者的复发性梭状芽胞杆菌感染。17。儿科感染soc。2018; 7(1):E6-E8。 Chen LA,Hourigan S,Radin A等。 粪便菌群移植后6个月内的胆汁酸成分在艰难梭菌感染的儿童中发生了6个月的变化:2016 ACG总统期海报奖。 Am J胃肠道。 2016; 111:S453-S454。 18。 CHO S,Spencer E,Hirten R,Grinspan A,Dubinsky MC。 粪便中的粪便中,用于小儿炎症性肠病中艰难梭菌感染的复发性梭状芽胞杆菌感染。 J Pediatr胃肠道Nutr。 2019; 68(3):343-7。 19。 Kronman MP,Nielson HJ,Adler AL等。 粪便微生物群通过鼻胃管转移了小儿患者的复发性梭状芽胞杆菌感染。 J Pediatr胃肠道Nutr。 2015; 60(1):23-6。 20。 Pierog A,Mencin A,Reilly NR。 粪便菌群复发性艰难梭菌感染儿童的移植。 儿科感染Dis J. 2014; 33(11):1198-200。 21。 Russell GH,Kaplan JL,Youngster I等。 粪便移植用于患有炎症性肠病和炎症性炎症性疾病的儿童艰难梭菌感染。 J Pediatr胃肠道Nutr。 2014; 58(5):588-92。2018; 7(1):E6-E8。Chen LA,Hourigan S,Radin A等。粪便菌群移植后6个月内的胆汁酸成分在艰难梭菌感染的儿童中发生了6个月的变化:2016 ACG总统期海报奖。Am J胃肠道。2016; 111:S453-S454。 18。 CHO S,Spencer E,Hirten R,Grinspan A,Dubinsky MC。 粪便中的粪便中,用于小儿炎症性肠病中艰难梭菌感染的复发性梭状芽胞杆菌感染。 J Pediatr胃肠道Nutr。 2019; 68(3):343-7。 19。 Kronman MP,Nielson HJ,Adler AL等。 粪便微生物群通过鼻胃管转移了小儿患者的复发性梭状芽胞杆菌感染。 J Pediatr胃肠道Nutr。 2015; 60(1):23-6。 20。 Pierog A,Mencin A,Reilly NR。 粪便菌群复发性艰难梭菌感染儿童的移植。 儿科感染Dis J. 2014; 33(11):1198-200。 21。 Russell GH,Kaplan JL,Youngster I等。 粪便移植用于患有炎症性肠病和炎症性炎症性疾病的儿童艰难梭菌感染。 J Pediatr胃肠道Nutr。 2014; 58(5):588-92。2016; 111:S453-S454。18。CHO S,Spencer E,Hirten R,Grinspan A,Dubinsky MC。粪便中的粪便中,用于小儿炎症性肠病中艰难梭菌感染的复发性梭状芽胞杆菌感染。J Pediatr胃肠道Nutr。2019; 68(3):343-7。 19。 Kronman MP,Nielson HJ,Adler AL等。 粪便微生物群通过鼻胃管转移了小儿患者的复发性梭状芽胞杆菌感染。 J Pediatr胃肠道Nutr。 2015; 60(1):23-6。 20。 Pierog A,Mencin A,Reilly NR。 粪便菌群复发性艰难梭菌感染儿童的移植。 儿科感染Dis J. 2014; 33(11):1198-200。 21。 Russell GH,Kaplan JL,Youngster I等。 粪便移植用于患有炎症性肠病和炎症性炎症性疾病的儿童艰难梭菌感染。 J Pediatr胃肠道Nutr。 2014; 58(5):588-92。2019; 68(3):343-7。19。Kronman MP,Nielson HJ,Adler AL等。 粪便微生物群通过鼻胃管转移了小儿患者的复发性梭状芽胞杆菌感染。 J Pediatr胃肠道Nutr。 2015; 60(1):23-6。 20。 Pierog A,Mencin A,Reilly NR。 粪便菌群复发性艰难梭菌感染儿童的移植。 儿科感染Dis J. 2014; 33(11):1198-200。 21。 Russell GH,Kaplan JL,Youngster I等。 粪便移植用于患有炎症性肠病和炎症性炎症性疾病的儿童艰难梭菌感染。 J Pediatr胃肠道Nutr。 2014; 58(5):588-92。Kronman MP,Nielson HJ,Adler AL等。粪便微生物群通过鼻胃管转移了小儿患者的复发性梭状芽胞杆菌感染。J Pediatr胃肠道Nutr。2015; 60(1):23-6。 20。 Pierog A,Mencin A,Reilly NR。 粪便菌群复发性艰难梭菌感染儿童的移植。 儿科感染Dis J. 2014; 33(11):1198-200。 21。 Russell GH,Kaplan JL,Youngster I等。 粪便移植用于患有炎症性肠病和炎症性炎症性疾病的儿童艰难梭菌感染。 J Pediatr胃肠道Nutr。 2014; 58(5):588-92。2015; 60(1):23-6。20。Pierog A,Mencin A,Reilly NR。粪便菌群复发性艰难梭菌感染儿童的移植。儿科感染Dis J.2014; 33(11):1198-200。 21。 Russell GH,Kaplan JL,Youngster I等。 粪便移植用于患有炎症性肠病和炎症性炎症性疾病的儿童艰难梭菌感染。 J Pediatr胃肠道Nutr。 2014; 58(5):588-92。2014; 33(11):1198-200。21。Russell GH,Kaplan JL,Youngster I等。粪便移植用于患有炎症性肠病和炎症性炎症性疾病的儿童艰难梭菌感染。J Pediatr胃肠道Nutr。2014; 58(5):588-92。2014; 58(5):588-92。
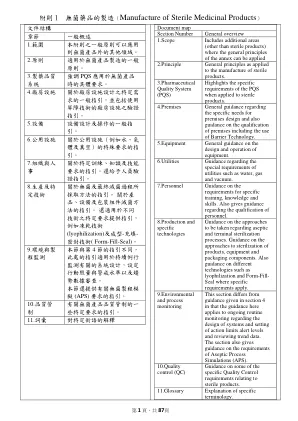
附则1无菌药品的制造(Manufacture of Sterile Medicinal ...
The manufacture of sterile products covers a wide range of sterile product types (active substance, excipient, primary packaging material and finished dosage form), packed sizes (single unit to multiple units), processes (from highly automated systems to manual processes) and technologies (e.g. biotechnology, classical small molecule manufacturing systems and closed systems). This Annex provides general guidance that should be used in the design and control of facilities, equipment, systems and procedures used for the manufacture of all sterile products applying the principles of Quality Risk Management (QRM), to ensure that microbial, particulate and endotoxin/pyrogen contamination is prevented in the final product. QRM 完全適用於本文件各章節,通常不會於特定 段落中再提及。在指出特定限量、頻率或範圍的地 方,這些應被視為最低要求;之所以加以陳述,是 基於監管經驗識別出且影響患者安全的歷史事件。
纤维素分解菌热纤梭菌中 IB 型和 II 型 CRISPR/Cas 基因组编辑系统的开发
C. thermocellum 强大的木质纤维素溶解活性使其成为生物燃料生产综合生物加工的最佳候选者。C. thermocellum 的遗传技术落后于模式生物,从而限制了改进生物燃料生产的尝试。为了提高对 C. thermocellum 进行工程改造的能力,我们表征了天然的 I-B 型和异源的 II 型成簇的规律间隔短回文重复 (CRISPR)/cas(CRISPR 相关)系统。我们将天然的 I-B 型系统重新用于基因组编辑。我们测试了三种嗜热 Cas9 变体(II 型),发现从 Geobacillus stear-othermophilus 中分离的 GeoCas9 在 C. thermocellum 中具有活性。我们采用 CRISPR 介导的同源定向修复将无义突变引入 pyrF 。对于这两种编辑系统,修复模板和基因组之间的同源重组似乎是限制步骤。为了克服这一限制,我们测试了三种新型嗜热重组酶,并证明从 Acidithiobacillus caldus 中分离的 exo / beta 同源物在 C. thermocellum 中具有功能性。对于 I-B 型系统,一种名为 LL1586 的工程菌株在 pyrF 基因座处产生了 40% 的基因组编辑效率,当表达重组机制时,这一效率增加到 71%。对于 II 型 GeoCas9 系统,观察到 12.5% 的基因组编辑效率,当表达重组机制时,这一效率增加到 94%。通过将嗜热 CRISPR 系统(I-B 型或 II 型)与重组酶相结合,我们开发了一种可实现高效 CRISPR 编辑的新工具。现在,我们准备利用 CRISPR 技术更好地改造 C. thermocellum,以增加木质纤维素降解和生物燃料生产。
改良产气荚膜梭菌肠毒素靶向 claudin 过度表达的甲状腺癌和肺癌
产气荚膜梭菌肠毒素 (CPE) 可用于消除细胞表面 CPE 受体(一种 claudins 亚群,例如 Cldn3 和 Cldn4)过表达的癌细胞。但是,CPE 无法靶向仅表达 CPE 不敏感 claudins(例如 Cldn1 和 Cldn5)的肿瘤。为了克服这一限制,使用结构引导修饰来生成可以与 Cldn1、Cldn2 和/或 Cldn5 强结合的 CPE 变体,同时保持与 Cldn3 和 Cldn4 结合的能力。这使得 (a) 能够靶向最常见的内分泌恶性肿瘤,即 Cldn1 过表达的甲状腺癌,以及 (b) 能够更好地靶向全球最常见的癌症类型,即非小细胞肺癌 (NSCLC),该类型的特点是高表达几种 claudins,包括 Cldn1 和 Cldn5。不同的 CPE 变体,包括新型突变体 CPE-Mut3 (S231R/S313H),被应用于甲状腺癌 (K1 细胞) 和 NSCLC (PC-9 细胞) 模型。体外实验中,CPE-Mut3 而非 CPEwt 表现出对 K1 细胞的 Cldn1 依赖性结合和细胞毒性。对于 PC-9 细胞,与 CPEwt 相比,CPE-Mut3 改善了紧密连接蛋白依赖性的细胞毒性靶向性。体内实验中,在带有 K1 或 PC-9 肿瘤的异种移植模型中瘤内注射 CPE-Mut3 可诱导坏死并减缓两种肿瘤类型的生长。因此,通过使用新型 CPE-Mut3,定向修饰 CPE 能够消灭 CPEwt 无法靶向的肿瘤实体,例如过表达 Cldn1 的甲状腺癌。
艰难梭菌感染和免疫检查点抑制剂诱导的黑色素瘤结肠炎:18例和文献综述
免疫疗法已成为多种类型癌症(例如黑色素瘤)的护理标准。但是,它可以诱导毒性,包括免疫检查点抑制剂诱导的结肠炎(CIC)。CIC具有炎症性肠病(IBD)的几种临床,组织学,生物学和治疗特征。艰难梭菌感染(CDI)会使IBD的演变变得复杂。我们旨在表征抗CTLA-4和抗PD-1的CDI与CIC之间的关联。来自2010年至2021年的抗CTLA-4和抗PD-1的九个中心的患者和抗PD-1的患者包括在2010年至2021年。主要终点是CIC的出现。次要终点是发现CDI的发现。包括18名患者。用抗PD-1,四个用抗CTLA-4和抗PD-1与抗PD-1与抗CTLA-4结合使用抗PD-1,四个。在18例患者中,有6例分离出CDI,而12例患有CIC和CDI。在这12位患者中,有8例CIC患有CDI复杂,三个同时使用CIC和CDI,其中1例患有CDI,其次是CIC。CDI在三名患者中是暴发的。内窥镜和组织学特征并未具体区分CDI与CIC。CDI
gumbeli属的DNA条形码区域,来自Honshu
真核生物coi M 13 f_lco 1490 (M 13 f)ggtcaaatcatattgg 1 658 bp又は815bp m 13 r_hco 2198 m 13 r_hcoout 13 R(R)TAACTTCAGGGGTGTGTGICCAAAAAAAAAAATCA (M 13 R)GTAATATATSGRTGDGCTC 1 2
大豆病原真菌的土壤田分析
本研究的主要目的是分离和形态学鉴定与大豆植株相关的真菌以及乌兹别克斯坦大豆种植田土壤层中的真菌。通过对从田间调查中采集的 160 个大豆植株部分进行真菌学研究,分离出 95 种腐生和植物病原真菌菌株,根据种类分配,其分布如下:链格孢属 3%、菊池尾孢 3%、毛霉属 3%、炭疽菌 3%、灰葡萄孢 3%、F. Heterosporum 4%、Penissulium spp. 7%、镰刀菌属。 8%、链格孢属9%、木霉属9%、黑曲霉10%、黄色镰刀菌11%、尖镰孢菌13%、镰刀菌14%。通过对土壤样品进行真菌学研究,共回收了40个真菌分离株,其种类分配如下:链格孢属、镰刀菌属、木霉属、尖镰孢菌、黄色镰刀菌、链格孢菌、镰刀菌、黑曲霉、Penissulium sp. 毛霉属。本研究获得的真菌分离株可用于促进乌兹别克斯坦大豆病害有效综合管理的发展。