XiaoMi-AI文件搜索系统
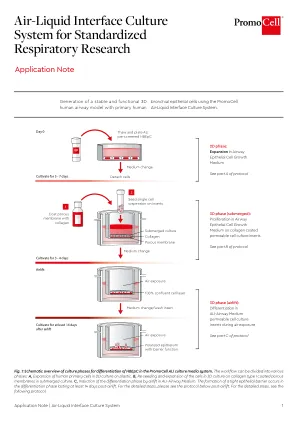
World File Search System气液界面培养系统 | PromoCell
在气液界面 (ALI) 生长的分化原代细胞的转录谱与体内气道上皮非常相似,这表明使用原代培养物和存在气液界面对于重现气道上皮生物学非常重要。此外,不同人类供体内部和之间的气管和支气管来源细胞之间非常相似,这表明气道细胞具有特有的强大表达谱 [1]。因此,体外 ALI 模型被推荐用于研究呼吸道的生理和病理生理反应、分子事件以及不同细胞类型的作用方式和相互作用 [2]。分化良好的体外气道上皮培养物的特点是形成假复层上皮和相邻环境之间的屏障功能。尽管气道上皮细胞在塑料上的二维培养中不会分化,但它们在气液界面的多孔膜上生长时可以发生粘液纤毛分化。气液界面通过支持上皮细胞的分化来实现上皮细胞的极化[3]。
科学计划
Isabelle Dupin,波尔多大学 使用患者来源的成体干细胞构建肺类器官模型,以了解慢性阻塞性疾病 Vivek Thacker,海德堡大学诊所 结核病的微生理模型 Camilla Tvedt Ekanger,卑尔根大学 用于人类呼吸道病毒感染研究的气液界面 transwell 和气道类器官模型的比较 Mara Fischer,柏林夏里特医学院 向用于肺炎链球菌感染的免疫功能正常的人类肺类器官模型迈进 海报会议/咖啡休息 观点:柏林夏里特医学院的 Jennifer Rosowski 谈柏林新兴的 3R 网络 第 2 场:血脑屏障 (BBB) 17:00 – 17:30 17:30 – 17:45 17:45 – 18:00 18:30
CLDN1 敲除角质形成细胞作为研究多种皮肤病的模型
图 2 CLDN1 敲除会降低 N/TERT-2G 单层细胞和器官型细胞浸没培养物中的屏障完整性。浸没单层细胞培养物在高 Ca 2 + 培养基中分化。通过 (A) 分化后 5 天内每天的跨上皮电阻 (TEER) 或 (B) 分化后 1、2 和 3 天的通透性测定来量化屏障功能。WT、pCLDN1 KO 和 A8 克隆细胞用于开发器官型培养物,并且 (C) 在提升到气液界面 10 天后测量电阻抗。-gRNA、pCLDN1 KO n = 4 个实验(A、B)。B6、A8、H1 克隆 n = 3 个实验和 D5 克隆 n = 1 个实验(A、B)。n = 3-9 个来自三个实验的总构建体,不同的符号代表各个实验(C)。通过配对 t 检验 (A、B) 或 ANOVA (A、B、C) 评估与相关 WT 对照的统计差异。数据以平均值 ± SEM 表示。 * p < 0.05,** p < 0.01。
科学计划
Isabelle Dupin,波尔多大学 使用患者来源的成体干细胞构建肺类器官模型,以了解慢性阻塞性疾病 Vivek Thacker,海德堡大学诊所 结核病的微生理模型 Camilla Tvedt Ekanger,卑尔根大学 用于人类呼吸道病毒感染研究的气液界面 transwell 和气道类器官模型的比较 Mara Fischer,柏林夏里特医学院 向用于肺炎链球菌感染的免疫功能正常的人类肺类器官模型迈进 海报会议/咖啡休息 观点:柏林夏里特医学院的 Jennifer Rosowski 谈柏林新兴的 3R 网络 第 2 场:血脑屏障 (BBB)(主席:M. Guedes、M. Neyazi) 17:00 – 17:30 17:30 – 17:45 17:45 – 18:00 18:30
PNA 纳米粒子介导的囊性纤维化的体内矫正
囊性纤维化 (CF) 是由 CF 跨膜传导调节器 (CFTR) 基因突变引起的。我们试图通过系统性递送肽核酸基因编辑技术(由生物相容性聚合物纳米颗粒介导)来纠正 F508del CF 致病突变引起的多器官功能障碍。我们在气液界面生长的 F508del 小鼠的原代鼻上皮细胞中证实了体外表型和基因型修饰,并在静脉内递送后在 F508del 小鼠体内证实了表型和基因型修饰。体内治疗导致上皮细胞中 CFTR 功能部分增强(通过原位电位差和 Ussing 室测定测量)以及气道和胃肠道组织中的 CFTR 得到纠正,并且没有高于背景的脱靶效应。我们的研究表明系统性基因编辑是可能的,更具体地说,静脉内递送旨在纠正 CF 致病突变的 PNA NP 是改善多个受影响器官中 CF 的可行选择。