XiaoMi-AI文件搜索系统
World File Search SystemCSPC PHARMACEUTICAL GROUP LIMITED 石药集团...
神经系统治疗领域第三季度收入较去年同期减少15.8%,但期内该领域收入较去年同期整体增长4.5%。恩必普®(丁苯酞软胶囊及丁苯酞氯化钠注射液)今年第三季度销售大幅下降,主要由于医院严控医疗费用,对使用量较大的药品进行管控。另一方面,明复乐®(注射用重组人TNK组织型纤溶酶原激活剂)自今年初获得治疗急性缺血性脑卒中新适应症的上市许可后,期内销售取得满意成绩。
MenQuadfi,INN - A、C、W 和 Y 群脑膜炎球菌结合疫苗
药品名称 MenQuadfi 注射液 脑膜炎球菌 A、C、W 和 Y 组结合疫苗 定性和定量组成 一剂(0.5 毫升)含: A 组脑膜炎奈瑟菌多糖 1 10 微克 C 组脑膜炎奈瑟菌多糖 1 10 微克 Y 组脑膜炎奈瑟菌多糖 1 10 微克 W 组脑膜炎奈瑟菌多糖 1 10 微克 1 与破伤风类毒素载体蛋白结合 55 微克 有关辅料的完整列表,请参阅辅料列表部分。 药物形式 注射液。无色透明溶液。临床特点 治疗指征 MenQuadfi 适用于对 12 个月及以上的个体进行主动免疫,以预防由脑膜炎奈瑟菌 A、C、W 和 Y 血清群引起的侵袭性脑膜炎球菌病。该疫苗的使用应符合现有的官方建议。 用法用量 用法用量 初次接种: • 12 个月及以上的个体:单剂量(0.5 毫升)。 加强接种: • 单剂量 0.5 毫升 MenQuadfi 可用于加强先前接种过含有相同血清群的脑膜炎球菌疫苗的受试者(参见药效学特性部分)。 • 接种 MenQuadfi 后的长期抗体持久性数据可在接种后长达 7 年内获得(参见特殊警告和使用注意事项和药效学特性部分)。 • 没有数据表明是否需要或何时给予 MenQuadfi 加强剂量(参见药效学特性部分)。
生物医药产品EDA评估报告
1. 产品概述,包括AI的简要描述,其作用方式和适应症 -Men AC注射液为 - A组脑膜炎球菌大分子多糖:无色或淡黄色,无味,澄清液体。 该大分子多糖含有A组脑膜炎球菌抗原和来自A组脑膜炎球菌的微量蛋白质和核酸。 该大分子多糖可对A组脑膜炎球菌特异性抗体产生免疫反应。 C组脑膜炎球菌大分子多糖:无色或淡黄色,无味,澄清液体。 该大分子多糖含有C组脑膜炎球菌抗原和来自C组脑膜炎球菌的微量蛋白质和核酸。 该大分子多糖可对C组脑膜炎球菌特异性抗体产生免疫反应 -该药物产品的成分包括:
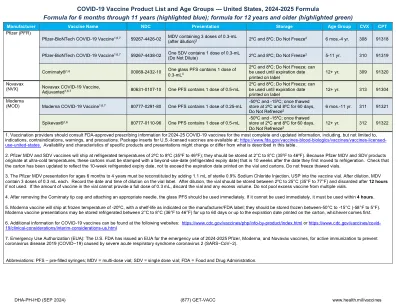
2024 年至 2025 年 COVID-19 疫苗产品清单及年龄组
3. 辉瑞 MDV 适用于 6 个月至 4 岁的儿童,必须将 1.1 mL 无菌 0.9% 氯化钠注射液 (USP) 添加到疫苗瓶中以重新配制。稀释后,MDV 含有 3 剂,每剂 0.3 mL。在疫苗瓶标签上记录稀释的日期和时间。稀释后,疫苗瓶应储存在 2ºC 至 25°C (35°F 至 77°F) 之间,如果未使用,则在 12 小时后丢弃。如果疫苗瓶中的疫苗量不能提供 0.3 mL 的完整剂量,则丢弃疫苗瓶和任何多余的量。不要将多个疫苗瓶中的多余疫苗混合在一起。
COVID-19 疫苗阿斯利康 - REG 174 信息...
英国卫生和社会保健部和药品与保健产品管理局已授权此药品临时供应。它没有上市许可,但此临时授权允许该药品用于 18 岁及以上人群的主动免疫,以预防 2019 年冠状病毒病 (COVID-19)。与英国的任何新药一样,该产品将受到密切监控,以便快速识别新的安全信息。要求医疗保健专业人员报告任何疑似不良反应。有关如何报告不良反应,请参阅第 4.8 节。 1. 药品名称 COVID-19 疫苗 阿斯利康,注射液 COVID-19 疫苗 (ChAdOx1-S [重组]) 2. 定性和定量组成 一剂(0.5 毫升)含: COVID-19 疫苗(ChAdOx1-S * 重组) 5 × 10 10 个病毒颗粒 (vp) * 重组、复制缺陷型黑猩猩腺病毒载体,编码 SARS-CoV-2 刺突 (S) 糖蛋白。在转基因人胚胎肾 (HEK) 293 细胞中产生。 本产品含有转基因生物 (GMO)。 已知作用的辅料 每剂(0.5 毫升)约含 2 毫克乙醇。有关辅料的完整列表,请参见第 6.1 节。 3. 药物形式 注射液。该溶液呈无色至微棕色、澄清至微不透明状,pH 值为 6.6。4. 临床特点 4.1 治疗指征 COVID-19 疫苗阿斯利康适用于 18 岁以上个体的主动免疫,以预防由 SARS-CoV-2 引起的 COVID-19。COVID-19 疫苗阿斯利康的使用应符合官方建议。4.2 用法用量和给药方法用法用量 18 岁及以上的个人 COVID-19 疫苗阿斯利康疫苗接种疗程包括两剂,每剂 0.5 毫升。第二剂应在第一剂后 4 至 12 周内注射(见第 5.1 节)。
R757-2-附件-II.pdf
如何使用 TEVA 仿制 EPIPEN®(肾上腺素注射液,USP)自动注射器,TEVA 制药工业 1. 迅速沿“扭转箭头”方向扭转自动注射器的黄色或绿色盖子将其取下。 2. 握紧自动注射器,橙色尖端(针头)朝下。 3. 用另一只手拉开蓝色安全释放装置。 4. 将橙色尖端与大腿外侧(大腿)中部成直角(垂直)。 5. 摆动自动注射器并将其牢牢推入大腿外侧中部,直至听到“咔”的一声。 6. 稳稳地保持 3 秒钟(慢慢数 1、2、3)。 7. 取下并按摩注射部位 10 秒钟。 8. 拨打911并立即获得紧急医疗救助。
ADUHELM(aducanumab - accessdata.fda.gov
_______________ 剂量和用法 ______________ • 开始治疗时需要进行滴定。 ( 2.1 ) • 建议的维持剂量为每四周约一小时静脉输注 10 mg/kg。 ( 2.1 ) • 在开始治疗前,获取最近的(一年内)脑部 MRI。 ( 2.2, 5.1 ) • 在第 7 次和第 12 次输注前获取 MRI。 如果观察到严重的 ARIA-H 放射学表现,则仅在临床评估和后续 MRI 显示放射学稳定(即 ARIA-H 的大小或数量没有增加)后才可以谨慎继续治疗。 ( 2.2, 5.1 ) • 给药前需要用 100 mL 0.9% 氯化钠注射液 (USP) 稀释。 (2.4)• 通过 0.2 或 0.22 微米的在线过滤器进行静脉输注,持续时间约一小时。(2.5)
新西兰的 COMIRNATY COVID-19 疫苗
• 标签还将说明它们是在紧急使用授权下使用的。此声明已纳入美国食品药品监督管理局 (FDA) 的要求,但与疫苗在新西兰的使用无关或不适用。 • 标签将说明疫苗在使用前必须用无菌 0.9% 氯化钠注射液 USP 稀释。但是,任何药典级的无菌 0.9% 氯化钠都可用于稀释此疫苗。 • 说明书中使用的名称“BNT 162b2 (SARS-COV-2-mRNA 疫苗) 5 剂量小瓶”不适用于新西兰。如上所述,新西兰供应的疫苗将以不同的方式提及)。 • 小瓶指示记录稀释的日期和时间,这与 Medsafe 批准的数据表中的说明一致。 2. 以商品名“COMIRNATY”供应的产品: