XiaoMi-AI文件搜索系统
World File Search System快乐
1 适应症和用途 1.1 周期性发热综合征 1.2 斯蒂尔病(成人斯蒂尔病 [AOSD] 和系统性幼年特发性关节炎 [SJIA]) 1.3 痛风发作 2 剂量和给药 2.1 一般剂量信息 2.2 冷吡啶相关周期性综合征(CAPS)的推荐剂量 2.3 肿瘤坏死因子受体相关周期性综合征 (TRAPS)、高免疫球蛋白 D 综合征/甲羟戊酸激酶缺乏症 (HIDS/MKD) 和家族性地中海热 (FMF) 的推荐剂量 2.4 斯蒂尔病的推荐剂量,包括成人斯蒂尔病 (AOSD) 和系统性幼年特发性关节炎 (SJIA) 2.5 痛风发作的推荐剂量2.6 ILARIS 注射液给药说明 3 剂型和强度 4 禁忌症 5 警告和注意事项 5.1 严重感染 5.2 免疫抑制 5.3 超敏反应 5.4 免疫接种 5.5 巨噬细胞活化综合征 6 不良反应 6.1 临床试验经验 6.2 免疫原性 6.3 上市后经验
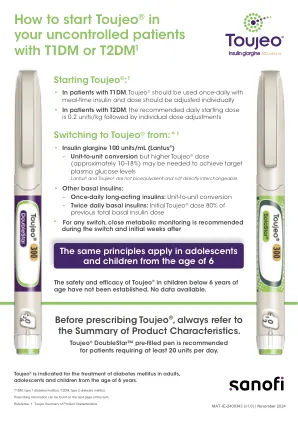
如何对未受控制的患者开始使用 Toujeo® ...
请在开具处方前参阅产品特性总结 (SmPC)。介绍:Toujeo SoloStar 和 DoubleStar 预充式注射笔。每毫升含有 300 单位甘精胰岛素。SoloStar 笔含有 1.5 毫升(450 单位)注射液。DoubleStar 笔含有 3 毫升(900 单位)注射液。适应症:治疗成人、青少年和 6 岁以上儿童的糖尿病。剂量和用法:Toujeo 皮下注射,每天一次,在一天中的任何时间注射到腹壁、三角肌或大腿,最好每天同一时间注射。为了降低脂肪营养不良和皮肤淀粉样变性的风险,必须在给定的注射区域内从一次注射轮换到下一次注射。应根据个体反应调整给药方案(剂量和时间)。请勿静脉注射。对于 1 型糖尿病患者,Toujeo 必须与短效/速效胰岛素联合使用,以满足进餐时胰岛素需求。对于 2 型糖尿病患者,建议的每日起始剂量为 0.2 单位/千克,然后根据个人情况调整剂量。Toujeo 也可与其他抗高血糖药物一起服用。在 100 单位/毫升甘精胰岛素和 Toujeo 之间切换:100 单位/毫升甘精胰岛素和 Toujeo 不具有生物等效性,不能直接互换。从 100 单位/毫升甘精胰岛素切换到 Toujeo 时,可以以单位为基础进行,但可能需要更高的 Toujeo 剂量(约 10-18%)才能达到血糖水平的目标范围。从 Toujeo 切换到 100 单位/毫升甘精胰岛素时,应减少剂量(约减少 20%)。从其他基础胰岛素转换为 Toujeo:可能需要改变基础胰岛素的剂量和/或时间以及同时进行的抗高血糖治疗。如果患者的体重或生活方式发生变化、胰岛素剂量时间发生变化或出现其他增加低血糖或高血糖敏感性的情况,也可能需要调整剂量。Toujeo 不得与任何其他胰岛素或其他药物混合或稀释。建议在转换期间以及转换后的最初几周内密切监测代谢。SoloStar 每次注射 1-80 单位,以 1 单位为增量;DoubleStar 2-160 单位,以 2 单位为增量。从 Toujeo SoloStar 转换为 Toujeo DoubleStar 时,如果患者之前的剂量为奇数,则剂量必须增加或减少 1 单位。Toujeo
巴西药典 - Portal Gov.br
醋酸钙 IF001-00 醋酸地塞米松 IF002-00 醋酸地塞米松乳膏 EF001-00 醋酸氢化可的松 IF003-00 醋酸甲羟孕酮 IF004-01 醋酸钠 IF005-00 乙酰唑胺 IF006-00 乙酰半胱氨酸 IF007-00 N-乙酰-L-蛋氨酸 IF008-00 阿昔洛韦 IF009-00 阿昔洛韦片 EF002-00 阿昔洛韦乳膏 EF003-00 乙酰水杨酸 IF010-01 乙酰水杨酸片 EF004-00 抗坏血酸IF011-01 抗坏血酸片 EF005-00 抗坏血酸注射液 EF006-00 苯甲酸 IF012-01 硼酸 IF013-00 柠檬酸 IF014-00 脱氢胆酸 IF015-00 硬脂酸 IF016-00 叶酸 IF017-00 叶酸片 EF007-00 磷酸 IF018-00 乳酸 IF019-00 甲芬那酸 IF020-01 萘啶酸 IF021-00 萘啶酸片 EF008-00 萘啶酸口服混悬液 EF009-00烟酸 IF022-01 对氨基苯甲酸 IF023-00 水杨酸 IF024-01 山梨酸 IF025-00 三氯乙酸 IF026-00 十一烯酸 IF027-00 腺苷 IF028-01 琼脂 IF029-00 灌溉用无菌水 IF030-00 注射用水 IF031-00 纯净水 IF032-00
上海复宏汉霖生物技术股份有限公司上海复宏汉霖生物技术...
HLX43是本公司将2022年11月从苏州医联生物技术有限公司引进的新型DNA拓扑异构酶I抑制剂负载——肽连接子与本公司自主开发的靶向PD-L1的抗体偶联物开发的针对PD-L1的抗体偶联物,用于治疗晚期/转移性实体瘤。2023年10月,HLX43用于治疗晚期/转移性实体瘤的1期临床试验申请获得国家药品监督管理局(“NMPA”)批准,并于2023年11月在中国大陆完成该项试验的首例患者给药。2023年11月,HLX43用于治疗晚期/转移性实体瘤的1期临床试验申请获得美国食品药品监督管理局(FDA)批准。 2024年12月,HLX43用于单药或联合治疗晚期/转移性实体瘤的1b/2期临床试验申请获得国家药品监督管理局批准;2025年1月,HLX43联合汉斯壮(赛普利单抗注射液)用于治疗晚期/转移性实体瘤患者的1b/2期临床试验申请获得国家药品监督管理局批准。
检测右向左分流的闪烁显像征象
众所周知,右向左分流可通过静脉注射放射性标记的大聚集白蛋白 (MAA) 颗粒 (1,23) 来检测和量化。由于直径大于 10 微米的颗粒被困在肺和体循环的帽层中,因此,肺外计数与全身计数的比率被认为反映了进入右心房的血液部分,该部分血液从右心分流到体循环。当施用的 MAA 溶液含有过量的未结合放射性核素或小于 10 微米大小的标记 MAA 碎片时,即使没有真正的分流,肺外计数与全身计数的比率也会显得异常高。当在甲状腺、唾液腺和胃粘膜中发现显著的 @9@c 活性时,可以推断注射液中存在大量未结合核素(游离高锝酸盐)。但从图像检查中无法可靠地辨别出是否存在少量游离高锝酸盐或@'9'c与小于10 @min大小的白蛋白颗粒结合,
为放射性配体治疗创建现成的健康系统...
12. 食品和药物管理局。 2020.Lutathera(镥(177Lu)氧化索肽)药物详情。 13. 食品和药物管理局。 2008. Zebarin Kit 注射液(Ibritumomabtucetan)药物详情。 14. 卫生和福利部。 2022. 102年度第五届健康保险政策审议委员会新闻稿(2.25)15.青年医生。 2022年,每年价值1亿韩元的罕见病治疗药物‘Lutathera’将从本月开始得到保障。 16. 电子医疗信息。 2002. Lutathera,神经内分泌肿瘤治疗的保险覆盖范围。 17. 新闻之声医疗保健。 2022. 鲁塔特拉,本利斯塔…… “为什么付款期限只限于韩国?” 18. 希拉。 2007.有关癌症药物和治疗的常见问题。 19.ClinicalTrials.gov。 https://clinicaltrials.gov/ct2/show/NCT00445965 20.ClinicalTrials.gov。 https://clinicaltrials.gov/ct2/show/NCT03971461 21.ClinicalTrials.gov。 https://clinicaltrials.gov/ct2/show/NCT04022213 22.ClinicalTrials.gov。 https://clinicaltrials.gov/ct2/show/NCT03392428 23. MFDS。 2022.临床试验批准状态。 24. 全国信息中心。 2020.按癌症类型划分的发生情况。
完整版 (PDF)
甲状腺成像膀胱成像(直接同位素膀胱造影)用于检测膀胱输尿管反流。禁忌症:未知。警告:使用高锝酸钠 Tc 99m 注射液相关的辐射风险对儿童比对成人更大,一般而言,儿童越小,由于吸收的辐射剂量越大、预期寿命越长,风险越大。在所有涉及儿童的效益风险评估中都应充分考虑这些更大的风险。长期累积辐射暴露可能会增加患癌症的风险。注意事项:总则与使用任何放射性物质一样,应注意在正确管理患者的情况下将患者受到的辐射暴露降至最低,并确保职业工人受到的辐射暴露降至最低。由于洗脱液不含抗菌剂,因此在洗脱后 12 小时不得使用。鼻泪管成像程序结束后,用无菌蒸馏水或等渗氯化钠溶液擤鼻涕和洗眼可进一步降低辐射剂量。放射性药物只能由经过培训并具备放射性核素安全处理经验的医生使用,并且其经验和培训已获得授权使用放射性核素的相应政府机构的批准。
完整版 (PDF)
甲状腺成像膀胱成像(直接同位素膀胱造影)用于检测膀胱输尿管反流。禁忌症:未知。警告:使用高锝酸钠 Tc 99m 注射液相关的辐射风险对儿童比对成人更大,一般而言,儿童越小,由于吸收的辐射剂量越大、预期寿命越长,风险越大。在所有涉及儿童的效益风险评估中都应充分考虑这些更大的风险。长期累积辐射暴露可能会增加患癌症的风险。注意事项:总则与使用任何放射性物质一样,应注意在正确管理患者的情况下将患者受到的辐射暴露降至最低,并确保职业工作者受到的辐射暴露降至最低。由于洗脱液不含抗菌剂,因此在洗脱后 12 小时不得使用。鼻泪管成像程序结束后,用无菌蒸馏水或等渗氯化钠溶液擤鼻涕和洗眼可进一步降低辐射剂量。放射性药物只能由经过培训并具备放射性核素安全处理经验的医生使用,并且其经验和培训已获得授权使用放射性核素的相应政府机构的批准。
自愿公告 KRAS G12C 抑制剂“GARSORASIB”片剂获上市许可
除已获批准的适应症外,集团正与益方生物合作推进加索拉西布用于一线治疗非小细胞肺癌及一线治疗包括胰腺癌和结直肠癌在内的其他实体瘤的临床试验。2024年6月,加索拉西布的两项新适应症被中国国家药品监督管理局药品审评中心纳入突破性治疗药物认定程序,即1)用于治疗一线治疗失败且伴有KRAS G12C突变的局部晚期或转移性胰腺导管腺癌患者;及2)与西妥昔单抗注射液联合用于治疗二线标准治疗(包括奥沙利铂、伊立替康、5-氟尿嘧啶及抗VEGF单克隆抗体)失败且KRAS G12C突变阳性且无法手术切除的局部晚期或转移性结直肠癌患者。集团将加快加索拉西布的临床开发,预期未来几年将进一步扩大加索拉西布的适应症,有望发展成为下一个与安罗替尼媲美的肿瘤重磅产品。
药物指南 硝酸甘油(静脉注射)
范围(区域):适用于:重症监护室、冠心病监护室、急诊室、CVS、手术室、4N 排除范围(人员):内科、护理和药房 品牌名称 DBL 或 Hospira 硝酸甘油浓缩物注射液®。 药理学和药代动力学 硝酸甘油可松弛动脉和静脉平滑肌,导致血管扩张,从而降低后负荷和前负荷。这导致心肌需氧量降低、冠状动脉扩张和血压降低。硝酸甘油起效迅速(1-2 分钟)、半衰期短(1-4 分钟)并且主要在肝脏清除。 适应症 不稳定型心绞痛。 急性心肌梗塞引起的心力衰竭。 高血压急症。 急性肺水肿。 某些外科手术过程中产生可控性低血压。 肺动脉高压的短期辅助治疗。 本指南不涵盖心血管套件中的专门用途。 禁忌症 低血压或未纠正的低血容量症 - 可能导致严重低血压或休克。 磷酸二酯酶 5 抑制剂 - 参见药物相互作用。 利奥西呱 - 参见药物相互作用。 麦角衍生物 - 参见药物相互作用。 颅内压升高(例如头部创伤或脑出血)。 缩窄性心包炎和心包填塞。 严重贫血和动脉低氧血症。 肥厚性梗阻性心肌病 - 硝酸甘油酯可能加重心绞痛,尤其是