XiaoMi-AI文件搜索系统
World File Search System丘脑底核的频率特异性光遗传学深部脑刺激可改善帕金森病的运动行为
丘脑底核 (STN) 的深部脑刺激 (DBS) 是治疗帕金森病 (PD) 运动症状的有效方法。然而,介导症状缓解的神经元素尚不清楚。先前的研究得出结论,直接光遗传学激活 STN 神经元对于缓解帕金森病症状既不是必要的也不是充分的。然而,用于细胞特异性激活的通道视紫红质-2 (ChR2) 的动力学太慢,无法跟上有效 DBS 所需的高速率,因此 STN 神经元的激活对 DBS 治疗效果的贡献仍不清楚。我们使用超快视蛋白 (Chronos) 量化了单侧 6-羟基多巴胺 (6-OHDA) 损伤后雌性大鼠的光遗传学 STN DBS 对行为和神经元的影响。 130 pps 的光遗传 STN DBS 减少了病理性旋转并改善了前肢踏步缺陷,类似于电 DBS,而使用 ChR2 的光遗传 STN DBS 不会产生行为效应。与电 DBS 一样,光遗传 STN DBS 表现出对刺激率的强烈依赖性;高刺激率可缓解症状,而低刺激率无效。高刺激率光遗传 DBS 可增加和减少 STN、苍白球外部 (GPe) 和黑质网状部 (SNr) 中单个神经元的放电率,并破坏 STN 和 SNr 中的 b 波段振荡活动。高速率光遗传学 STN DBS 确实可以通过减少 STN 相关神经回路中的异常振荡活动来改善帕金森病运动症状,这些结果强调了视蛋白的动力学特性对光遗传学刺激的效果有很大影响。
丘脑底核的频率特异性光遗传学深部脑刺激可改善帕金森病的运动行为
这篇早期发布的文章已经过同行评审并被接受,但尚未经过撰写和编辑过程。最终版本在风格或格式上可能略有不同,并将包含指向任何扩展数据的链接。
丘脑底核而非苍白球深部脑刺激期间直接激活初级运动皮层
丘脑底核 (STN) 和苍白球内核 (GPi) 的深部脑刺激 (DBS) 是治疗帕金森病运动症状的有效方法。尽管其治疗机制尚不清楚,但有研究表明,初级运动皮层 (M1) 的反向激活在介导其治疗效果方面起着重要作用。本研究检验了以下假设:M1 的反向激活是 STN 和 GPi DBS 治疗效果的一个显著特征。使用高密度微电极阵列在两只帕金森病非人类灵长类动物中记录了 M1 中的单元活动,每只动物都植入了针对 STN 和 GPi 的 DBS 导线。每个 DBS 靶标的刺激都有类似的治疗效果,但是,仅在 STNDBS 期间观察到 M1 的反向激活。尽管接受 STN DBS 的两只动物均具有相似的有益效果,但每种动物中反向分类细胞的比例不同,分别为 30% 和 6%。在连续 4 小时的 STN DBS 中,反向激活变得不那么强烈,而治疗效果却得以保持。尽管反向激活随着时间的推移而减弱,但在整个 4 小时内,M1 自发尖峰的同步显着降低。虽然我们不能至少在 STNDBS 的急性期忽略反向 M1 激活的潜在治疗作用,但动物和目标部位之间观察到的反向激活的差异引发了对其假设作用作为 DBS 治疗效果的主要机制的疑问。这些结果进一步支持了 M1 水平同步性的降低是 DBS 治疗效果的重要因素。
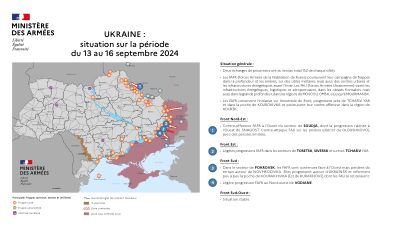
2024年9月13日至16日期间情况
• 俄罗斯联邦武装力量 (FAFR) 在冬季来临之前将继续对军事目标、城市中心和能源基础设施进行纵深和后方打击。乌克兰武装部队 (AFU) 的目标是边境州以及莫斯科、鄂木斯克和摩尔曼斯克等深部的能源、物流和机场基础设施。
ECL 15B驱动的堆叠器ECL 15B驱动的堆叠器
电池深部排放保护设备,电压放电指示器,具有低压自动切割和效力功能,可用于更高的电池寿命。证明的紧急开关和电压放电指示器,使其更耐用和可靠。指示器通过CAN-BUS显示故障,无需删除指示外壳。
虚拟深部脑刺激:使用虚拟大脑对尖峰基底神经节模型和全脑平均场模型进行多尺度联合模拟
- 我们实现并验证了一种针对基底神经节内和周围皮层下区域的脉冲网络模型的联合仿真方法,并将其与每个皮层区域的平均场网络模型相结合。 - 我们的模拟基于一个规范的连接组,包括皮层和基底神经节区域之间的详细路径,并结合了健康对照者和帕金森病患者的特定受试者优化权重。 - 我们通过证明所实现的模型在静息状态下显示出生物学上合理的动态来提供概念证明,包括虚拟患者的丘脑活动减少,以及虚拟深部脑刺激期间的丘脑活动正常化和主要在额叶区域的分布改变的皮层活动。 - 所提出的联合仿真模型可用于为个别患者定制深部脑刺激。摘要深部脑刺激 (DBS) 已成功应用于各种神经退行性疾病,作为一种有效的对症治疗。然而,它在大脑网络中的作用机制仍然知之甚少。许多虚拟 DBS 模型将基底神经节周围的子网络及其动态分析为脉冲网络,其细节由实验数据验证。然而,连接组学证据表明 DBS 的广泛影响影响了许多不同的皮质和皮质下区域。从临床角度来看,除了运动影响之外,DBS 的各种影响也已得到证实。神经信息学平台虚拟大脑 (TVB) 提供了一个建模框架,使我们能够虚拟地执行刺激(包括 DBS),并在进行 DBS 导线置入的侵入性手术之前从动态系统的角度预测结果。为了准确预测 DBS 的影响,我们实施了一个详细的基底神经节脉冲模型,并通过我们之前开发的联合仿真环境将其与 TVB 相结合。这
使用最佳点引导参数建议对帕金森病的丘脑底核深部脑刺激进行编程
深部脑刺激 (DBS) 是治疗晚期帕金森病的有效方法。然而,确定刺激参数(例如接触和电流幅度)需要反复试验,非常耗时。定向导线增加了更多的刺激选项,使这个过程更具挑战性,增加了神经科医生的工作量,也增加了患者的不适感。在这项研究中,开发了一种最佳点引导算法,可以自动建议刺激参数。这些建议与临床单极评论进行了回顾性比较。在我们中心,一组 24 名帕金森病患者在丘脑底核接受了双侧 DBS 植入。首先,使用开源工具箱 Lead-DBS 重建 DBS 导线。其次,将刚度降低的最佳点设置为编程所需的刺激目标。这个最佳点和激活组织体积的估计值用于建议 (i) 最佳导线水平、(ii) 最佳接触和 (iii) 每次接触完全治疗效果的效果阈值。为了评估这些最佳点引导建议,临床单极评论被视为基本事实。此外,最佳点引导的最佳导线水平和最佳接触建议与重建引导的建议进行了比较,后者考虑了导线相对于丘脑底核的位置。最后,开发了一个图形用户界面作为 Lead-DBS 的附加组件,可供公众使用。使用该界面,可以在几秒钟内生成导线所有接触的建议。建议最佳接触的准确性
神经技术在刑法中的应用机遇与风险
ACC 前扣带皮层 aDBS 自适应深部脑刺激 ALS 肌萎缩侧索硬化症 BCI 脑机接口 CT 计算机断层扫描 DBS 深部脑刺激 DTI 扩散张量成像 EcoG 皮层脑电图 ECT 电休克疗法 EEG 脑电图 ECtHR 欧洲人权法院 ECHR 欧洲人权公约 fMRI 功能性磁共振成像 fNIRS 功能性近红外光谱 fTDC 功能性经颅多普勒 fUSI 聚焦超声成像 GVM 行为和自由限制措施 ISD 惯犯机构 MEG 脑磁图 MRI 磁共振成像 MRS 磁共振波谱 MS 多发性硬化症 PET 正电子发射断层扫描 sEEG 立体定向脑电图 SPECT 单正电子发射计算机断层扫描 Sr 荷兰刑法典 Sv 荷兰刑事诉讼法典 TBS 置于机构支配下 tDCS 经颅直流电刺激TMS经颅磁刺激TRL技术成熟度TFUS经颅聚焦超声刺激WODC科学研究与文献中心
第 11 届年度深部脑刺激智库会议论文集:通过功能网络映射、自适应深部脑刺激的生物标志物、生物伦理困境、人工智能引导的神经调节和转化进展推动神经调节的前沿
引文 Johnson KA, Dosenbach NUF, Gordon EM, Welle CG, Wilkins KB, Bronte-Stewart HM, Voon V, Morishita T, Sakai Y, Merner AR, L´azaro-Mu˜noz G, Williamson T, Horn A, Gilron R, O'Keeeffe J, Gittis AH, Neumann WJ, Little S, Provenza NR, Sheth SA, Fasano A, Holt-Becker AB, Raike RS, Moore L, Pathak YJ, Greene D, Marceglia S, Krinke L, Tan H, Bergman H, P¨otter-Nerger M, Sun B, Cabrera LY, McIntyre CC, Harel N, Mayberg HS, Krystal AD, Pouratian N, Starr PA, Foote KD, Okun MS 和 Wong JK (2024) 第 11 届深部脑刺激智库会议论文集:推动神经调节的前沿,包括功能网络映射、自适应 DBS 的生物标志物、生物伦理困境、人工智能引导的神经调节和转化进展。Front. Hum. Neurosci. 18:1320806。doi:10.3389/fnhum.2024.1320806
深部脑刺激治疗难治性抑郁症后的个人和关系变化:一项针对患者和护理人员的前瞻性定性研究
深部脑刺激 (DBS) 是一种神经外科手术,目前正在对难治性抑郁症 (TRD) 患者进行试验。该手术涉及在被认为与抑郁症精神病理学相关的特定大脑区域植入电极。连续电脉冲从位于患者胸部的电池 (植入式脉冲发生器;IPG) 通过皮下导线发送到大脑。一系列目标区域已对 TRD 进行了试验,包括胼胝体下扣带回 [ 1 , 2 ]、腹侧囊/腹侧纹状体 [ 3 , 4 ]、内侧前脑束 [ 5 , 6 ] 和伏隔核 [ 7 , 8 ]。终纹床核 (BNST) 是近期关注的目标 [ 9 , 10 ],也是本样本的植入部位。DBS 已证明能够显着有效地缓解抑郁症状 [ 11 ]。然而,不同研究的反应率和缓解率差异很大,最佳患者特征、刺激参数和植入部位仍在研究中[12]。尽管 DBS 治疗 TRD 的有效性和安全性仍在临床试验中进行研究,但结果好坏参半[13],但尚未深入研究患者使用 DBS 的体验及其对所经历的社会心理变化的看法。DBS 对护理人员和家人的影响也未得到充分研究,无论是从定量还是定性角度。涉及 TRD 的 DBS 候选人的定性研究仅限于决策、同意能力[14-16]和对新兴闭环系统的态度[17]等问题。这些都是需要考虑的重要伦理问题,特别是在为潜在脆弱个体提供实验性治疗时[18,19]。但它们并未深入了解 DBS 的生活体验或其更广泛的社会心理影响。对因帕金森病 (PD) 等其他临床适应症而接受 DBS 的患者进行的定性研究已通过这种方法学方法获得了重要的见解[20]。对于 PD 患者,患者和护理人员描述了 DBS 后患者性格出现的积极和消极变化(例如,更有趣、开放、健谈;更具攻击性、自私、安静)[21]。随着 PD 症状的改善,患者和护理人员可以感觉到患者恢复了往日的自我[22]。但是,当患者出现意想不到的副作用(例如,易怒、强迫行为)时,配偶会觉得他们不再是同一个人的丈夫[23]。一些患者报告称,他们心理上难以接受植入的电气设备,并且身体形象发生改变,而护理人员在伴侣不再依赖他们时会感到“失落”[24]。对于强迫症 (OCD),患者将 DBS 后的变化描述为与他们所感知的真实自我或多或少一致,需要习惯现在的状态,或者需要找出没有强迫症的自己是谁 [ 25 ]。这些复杂且高度微妙的心理社会体验无法通过临床试验中使用的定量精神病理学和评估工具来捕捉。然而,它们可能对康复以及患者和护理人员的健康产生重大影响。因此,本研究的目的是定性地研究 DBS 治疗 TRD 如何影响患者的个性、自我