XiaoMi-AI文件搜索系统
World File Search System汞中心浸入式浅色产品SLPS和...
胸部X射线。尿液分析(24小时尿液收集)。头发测试(用于长期暴露)血液检查(全血细胞计数和代谢面板)。心电图。确认暴露于无机汞的最准确方法是尿液测试。第一个早晨的空隙与24小时的收集相关性高达85%,这是最准确的测试。肾功能测试,包括尿液分析,肌酐,面包,尿液微球蛋白和微藻尿症,应在尿液汞水平升高的个体中进行。血液汞水平不是无机汞暴露的准确指标。血液中的总汞通常小于6 µg/l。如上所述,应进行尿液汞水平升高的尿液测试。但是,在汞尿液水平> 5 µg/g肌酐的患者中,应每隔几个月重复一次尿液汞测试,以确认水平在下降,直到尿液水平低于5 µg/g肌酐。
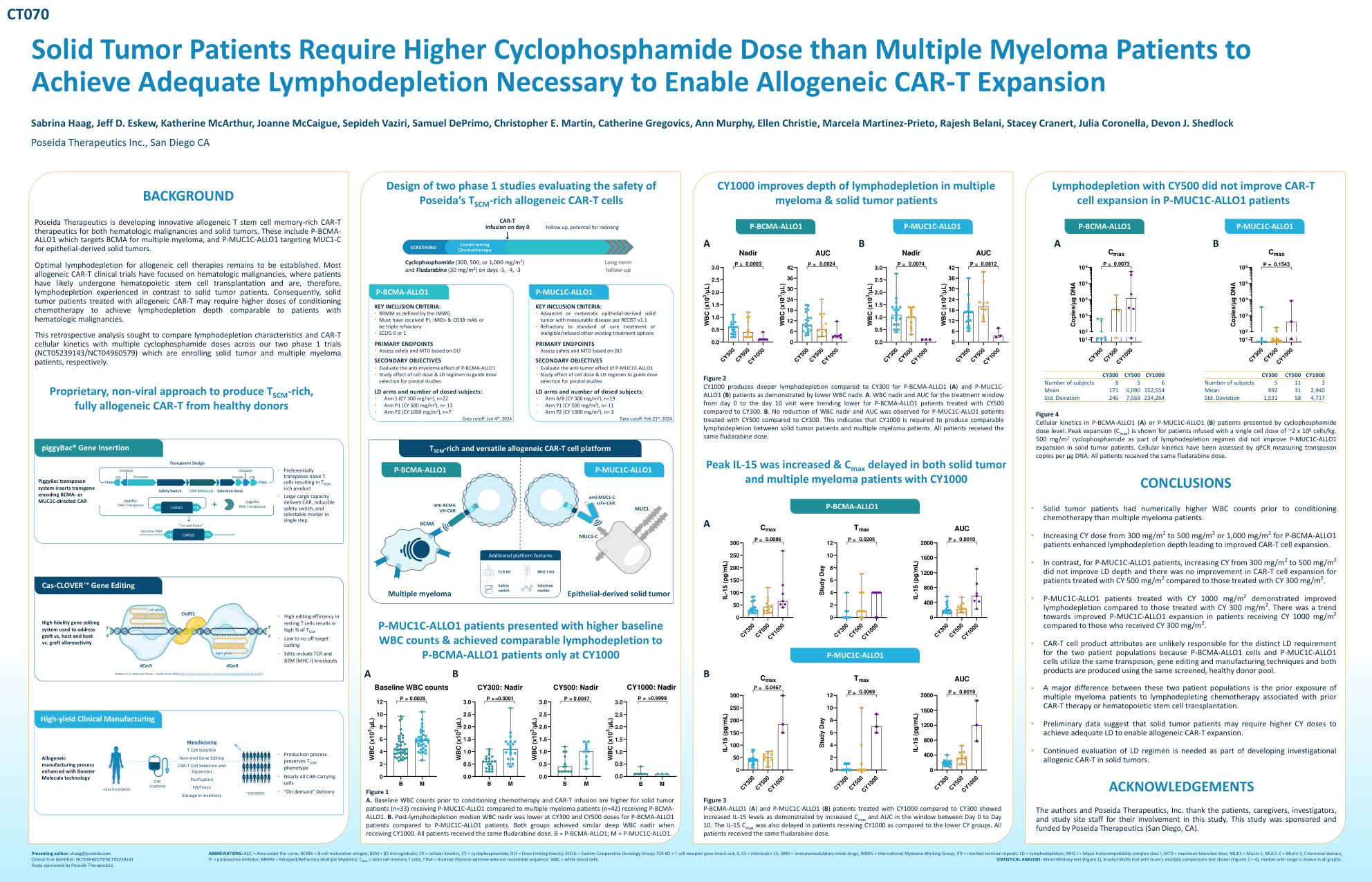
完全同种异体嵌合抗原受体 T 细胞 P-BCMA-ALLO1 的早期安全性和有效性结果
缩写:AUC = 曲线下面积;BCMA = B 细胞成熟抗原;B2M = β2 微球蛋白;CK = 细胞动力学;CY = 环磷酰胺;DLT = 剂量限制毒性;ECOG = 东部肿瘤协作组;TCR KO = T 细胞受体基因敲除;IL-15 = 白细胞介素 15;IMiD = 免疫调节酰亚胺药物;IMWG = 国际骨髓瘤工作组;ITR = 倒置末端重复序列;LD = 淋巴细胞耗竭;MHC I = 主要组织相容性复合体 I 类;MTD = 最大耐受剂量;MUC1 = 粘蛋白 1;MUC1-C = 粘蛋白 1,C 端结构域;PI = 蛋白酶体抑制剂;RRMM = 复发/难治性多发性骨髓瘤;T SCM = 干细胞记忆 T 细胞; TTAA = 胸腺嘧啶-胸腺嘧啶-腺嘌呤-腺嘌呤核苷酸序列;WBC = 白细胞。统计分析:Mann-Whitney 检验(图 1)、Kruskal-Wallis 检验与 Dunn 的多重比较检验(图 2 – 4),所有图表均显示中位数和范围。演示作者:shaag@poseida.com 临床试验标识符:NCT04960579/NCT05239143 由 Poseida Therapeutics 赞助的研究
瓦尔登斯特伦氏病指南
- 血细胞计数、分类血细胞计数 - 血型、抗体筛查测试 - 电解质(钠、钾、钙)、肌酐(包括计算的 GFR)、尿素、尿酸、LDH、GPT、GOT、铁状态(铁蛋白、转铁蛋白饱和度)、糖化血红蛋白 - proBNP 或 BNP、肌钙蛋白 T 或 I - 25-羟基胆钙化醇(检测维生素 D 缺乏症) - 肾功能不全或高钙血症时:1,25-二羟基胆钙化醇(维生素 D 代谢) - 总蛋白和白蛋白、免疫球蛋白定量(IgG、IgA、IgM)、β2-微球蛋白 - 血清蛋白电泳(SPEP)和 M 蛋白定量、免疫固定 - 游离 κ 和 λ 轻链、轻链比率 - 冷球蛋白 - 冷凝集素 - 疫苗接种状况、HIV 和肝炎血清学 - 维生素 B12、叶酸、促红细胞生成素(肾功能不全的情况下) - 通过 FACS 分析进行表面标志物检测(仅适用于白血病病程) - 出血倾向的情况下:vWF Ag 和活性 + 因子 VIII 测定(继发性 VW 综合征?)
沃尔玛和山姆会员店疫苗接种记录和知情同意书
10. 在过去一年中,待接种疫苗的人是否接受过抗体、输过血或血液制品、注射过免疫(丙种)球蛋白或抗病毒药物? 是 否 11. 待接种疫苗的人是否有血小板减少症或血小板减少性紫癜病史(仅限 MMR II)? 是 否 C 部分 请仔细阅读以下部分,并签名和注明日期,以确认您理解并同意。 我在此同意 Walmart(如适用)为我提供上述请求的药物。 我了解接种此药物的益处和风险,并且已收到、阅读和/或有人向我解释了我选择接种的疫苗的疫苗信息声明和/或疫苗患者情况说明书。 我承认我有机会提问,并且这些问题的答案令我满意。 我承认,接种后,接种医疗保健提供者建议我留在疫苗接种地点附近约 15 分钟,以便观察。我代表我自己、我的继承人和个人代表,完全免除沃尔玛、其职员、代理人、继任者、部门、附属公司、管理人员、董事、承包商和雇员因接种上述疫苗而产生的任何已知或未知的责任或索赔。首字母缩写:
用布鲁顿的酪氨酸激酶抑制剂治疗的患者的抗血栓性预防
ibrutinib均由欧洲药品局(EMA)批准以下血液学适应症:1)作为单一药物,用于治疗成年患者的复发或难治性地幔细胞淋巴细胞(MCL); 2)作为单一药物或与利妥昔单抗或obinutuzumab或venetoclax结合使用,用于治疗先前未经治疗的慢性淋巴细胞性白血病(CLL)的成年患者; 3)作为单一药物或与Bendamustine和Rituximab(BR)结合使用,用于治疗至少接受过一种先前治疗的CLL的成年患者; 4)作为一种犯罪药物,用于治疗成年患者Waldenström的巨型球蛋白血症(WM),这些患者至少接受过一种先前的治疗,或者在对不适合化学免疫疗法的不适合使用Rituximab结合使用Rituximab的患者的一线治疗中,以治疗患者患有WM的患者。Acalabrutinib获得批准:1)作为单一疗法或与Obinutuzumab结合使用,用于治疗先前未经治疗的慢性
β-血红蛋白病:基于基因组编辑的治疗策略的测试台
血红蛋白是一种由两个α和两个β链组成的四聚体蛋白,每个蛋白包含一个可逆地结合氧的血红素基团。为满足生长生物体的需求,血红蛋白变化的组成稳定地保持了1:1比例的α-样链和β-样链的平衡产生。成人血红蛋白(HBA)由两个α和两个β亚基(α2β2四聚体)组成,而胎儿血红蛋白(HBF)由两个γ和两个α亚基(α22γ2四型四室)组成。β-珠蛋白产生中的定性或定量缺陷引起两个最常见的单基因疾病:β-丘脑中性贫血和镰状细胞病。这些疾病的高频和造血干细胞的相对可及性使它们成为基于基因组编辑的治疗干预措施的理想候选者。这些策略朝两个方向移动:纠正引起疾病的突变和成人细胞中HBF表达的重新激活,以尝试重现遗传性胎儿血红蛋白(HPFH)天然突变的作用,从而减轻了β-血红蛋白毒素的严重性。两种研究线都取决于迄今为止获得的知识,这些知识是控制了发育过程中球蛋白基因差异表达的调节机制。
细胞和分子生物学
2型糖尿病(T2DM)会对许多系统和组织造成损害,例如自主神经,骨膜神经,微血管和微血管,从而导致多种糖尿病并发症,并严重递增患者的生活和健康。T2DM视网膜病(DR)是T2DM患者中最常见的微血管并发症之一,也是30至70岁患者失明的第一个原因。因此,如何预防和治疗DR已成为临床糖尿病杂志的重点。目前尚未充分解释DR的发病机理,但作为慢性炎症性免疫疾病,视网膜微血管炎症性疾病,信息和免疫异常是影响DR的重要致病因素。基质金属蛋白酶-2(MMP-2)是一种蛋白水解酶,可以通过调节细胞外基质的产生和降解,然后参与T2DM血管疾病的进展(1)来参与微血管结构的破坏(1)。组织抑制剂1(TIMP-1)是MMP-2的特定INHI BITOR,可以调节MMP-2(2)的生物学活性。此外,β2-微球蛋白(β2-mg)是由血小板,多形核白细胞和淋巴细胞形成的微小蛋白。最近的研究表明,糖尿病性肾病患者的血清β2-mg与微血管病密切相关。高度敏感的C-
针对微环境治疗多发性骨髓瘤
摘要:多发性骨髓瘤 (MM) 是一种恶性的、无法治愈的疾病,其特征是骨髓中单克隆终末分化浆细胞的扩增。MM 的发病前通常会出现意义不明的无症状单克隆丙种球蛋白病,在没有骨髓瘤定义事件的情况下,随后进入称为冒烟型多发性骨髓瘤 (SMM) 的阶段,如果出现器官损伤的迹象,最终会发展为活动性骨髓瘤。肿瘤细胞与肿瘤微环境之间的相互作用在 MM 的发展中起着至关重要的作用,而肿瘤促进基质的建立促进了肿瘤的生长和骨髓瘤的进展。由于骨髓瘤细胞依赖来自骨髓微环境 (BMME) 的信号来生存,因此针对 BMME 的治疗干预是一种新颖且成功的骨髓瘤治疗策略。本文描述了骨髓瘤细胞与 BMME 细胞成分之间的复杂相互作用,这对于 MM 的发展和进展至关重要。最后,我们介绍了 BMME 修饰治疗方案,例如基于抗 CD38 的疗法、免疫调节药物 (IMiD)、CAR-T 细胞疗法、双特异性抗体和抗体-药物偶联物,这些疗法显著改善了骨髓瘤患者的长期疗效,因此代表了新的治疗标准。
7860型测试单
液体人类血清UK NEQAS NEQAS每月临床化学化学钠氯化钠尿素葡萄糖磷酸氨基酸氨基酸肌酸肌酐胆红素总蛋白蛋白白蛋白白蛋白锂渗透压天冬氨酸透明质酸氨基氨基氨基氨基氨基糖(AST)丙氨酸酶(AST)丙氨酸透明酶(Alt)乳酸酶酶(ld)肌酸酶(LD)Alkasase(ld)Alkasase(ld)Alkase(CKAT)CKAT(CK)淀粉酶γ-谷氨酰转移酶(GGT)调整的碳酸氢钙铜D-3-羟基丁酸酸酸钙丁酸酯不饱和铁结合能力(UIBC)总铁结合能力(TIBC)脂肪酶脂肪酶乳酸乳酸乳酸阴离子间隙渗透间隙渗透素间隙球蛋白转移纤维纤维纤维纤维纤维纤维纤维纤维纤维纤维纤维纤维(Fibrin)(Fibrin fibrin fibrin fibrin fibrin fibrin fibrin fibrin fibrib-4 iniver liver)liver(liver)livir>
乙型肝炎诊断测试 - 核心概念
EIA和假阴性结果的敏感性:第三代HCV EIA的灵敏度约为98%。[8,9,10]与假阴性EIA相关的情况包括急性HCV感染的患者,具有重大免疫损害疾病的患者(晚期HIV感染或器官移植受者)以及长期血液疾病的慢性肾衰竭患者。EIA和假阳性结果的特异性:第三代HCV EIA的特异性大于99%;假阳性测试可能会随着自身免疫性疾病和免疫接种而发生的增加γ球蛋白产生。 [8]此外,在HCV患病率非常低的人群中进行广泛的测试时,错误的阳性测试更有可能。 化学发光免疫测定法(CIA):CIA测试是类似于EIA的抗体测试,但与EIA检验相比使用的频率较低。 用于诊断HCV,中央情报局具有与第三代EIA相似的敏感性和特异性。 [1,11]保健点快速免疫测定:Oraquick HCV快速抗体测试在2010年被美国食品药品监督管理局(FDA)批准,作为一项护理测试,可用于与Venipunctuncture或Fingererstick获得的全血样品一起使用。 这种Oraquick快速抗体测试可以用作初始HCV抗体测试的第三代EIA的替代方法。 [12,13,14,15]在将测试装置插入缓冲液后20至40分钟后,读取Oraquick测试,结果是反应性或无反应性(图2)。 [16,17]EIA和假阳性结果的特异性:第三代HCV EIA的特异性大于99%;假阳性测试可能会随着自身免疫性疾病和免疫接种而发生的增加γ球蛋白产生。[8]此外,在HCV患病率非常低的人群中进行广泛的测试时,错误的阳性测试更有可能。化学发光免疫测定法(CIA):CIA测试是类似于EIA的抗体测试,但与EIA检验相比使用的频率较低。用于诊断HCV,中央情报局具有与第三代EIA相似的敏感性和特异性。[1,11]保健点快速免疫测定:Oraquick HCV快速抗体测试在2010年被美国食品药品监督管理局(FDA)批准,作为一项护理测试,可用于与Venipunctuncture或Fingererstick获得的全血样品一起使用。这种Oraquick快速抗体测试可以用作初始HCV抗体测试的第三代EIA的替代方法。[12,13,14,15]在将测试装置插入缓冲液后20至40分钟后,读取Oraquick测试,结果是反应性或无反应性(图2)。[16,17][12,13] 2011年,FDA批准了Oraquick HCV快速抗体测试的临床实验室改进修订(CLIA)豁免。已经开发了额外的护理快速HCV抗体测试,但未批准在美国使用。