XiaoMi-AI文件搜索系统
World File Search SystemMTTI报告225AC-EBTATE和177LU- ...
MTTI在2024年5月21日,2024年5月21日,宾夕法尼亚州西切斯特市2024年的225个Ac-ebtate和177 lu-ebtate放射性药物报告,东部标准时间(商业线) - 分子靶向技术,MTTI和22 erttip。 6月8日至11日在多伦多举行的2024年SNMMI会议上的AC-Ebtate临床前工作(展位#1819)。177 lu-ebtate®一种eVathera药物,是第一个获得专利的长效肽靶向放射治疗药物。它在神经内分泌和其他肿瘤上有选择地靶向生长抑素受体2,然后被放射性核素有效载荷杀死。Evans Blue在Ebtate中与血清白蛋白结合,扩展了体内循环半衰期和肿瘤的停留时间,从而有效使用明显较低的放射性药物活性,而给当前护理标准(SOC)的给药周期较少。在最近对225个Ac-Ebtate同源物的研究中,这些好处也很明显。北北京联合医学院医院Zhaohui Zhu教授反映了“在我们的3年随访中,对30名患者*进行转移性神经内分泌肿瘤(MNET)(MNETS),177卢比特表现出良好的安全性,没有肾上腺素或86%的疾病控制速率,没有60%的放射性<177 luutation <177 luutation。我们观察到3级血毒性的发病率低(占报告SOC的15%),没有任何级别的长期肾毒性。”这项研究“长期作用225 Ac-ebtate对生长抑素受体-2阳性的小细胞肺癌(SCLC)高度有效**”,已被接受在2024 SNMMI上225 ac-ebtate对SCLC表现出巨大的希望。”萨斯喀彻温大学的Humphrey Fonge教授评论说:“ 225 Ac-ebtate(相距10天2x 30 kBq的管理)对SCLC有效,具有80%的完全恢复和100%的生存。治疗与225 ac量二酸酯相比,肿瘤生长抑制更大,给药的放射性降低了60%。通过体重,血液计数和化学的毒性表明,在高效的剂量下,225 ac-ebtate的耐受性良好。MTTI总裁兼首席执行官克里斯·巴克(Chris Pak)评论说:“我们很高兴得知177个Lu-ebtate没有任何安全问题,并且在MNET患者中的剂量低于SOC的剂量。我们还鼓励我们,225 ac-ebtate超过225 ac- dotatate,在临床前发现中,使用较低剂量的放射性抑制了肿瘤的生长抑制作用增加了2倍。我们期待在小细胞肺和其他癌症中使用这些放射性药物来推进我们的临床试验。”
治疗诊断学肽受体放射性核素治疗...
越来越多的文献报道了肽受体放射性核素治疗 (PRRT) 与其他抗肿瘤治疗的联合使用,以期产生协同效应,但可能增加安全性问题。增强 PRRT 结果的联合治疗基于改善肿瘤灌注、上调生长抑素受体 (SSTR)、使用 DNA 损伤剂进行放射增敏或靶向治疗。目前有几项 1 期或 2 期试验正在招募联合治疗方案的患者。PRRT 与细胞毒性化疗、卡培他滨和替莫唑胺 (CAPTEM) 的联合使用似乎具有临床应用价值,尤其是在胰腺神经内分泌肿瘤 (pNET) 中,且安全性可接受。目前正在进行的临床试验正在测试术前新辅助 PRRT、静脉和动脉内应用途径的 PRRT 组合、PRRT 与不同放射性标记(α、β、Auger)SSTR 靶向激动剂和拮抗剂的组合、免疫检查点抑制剂 (ICI)、聚(ADP-核糖)聚合酶-1 (PARP1i)、酪氨酸激酶 (TKI)、DNA 依赖性蛋白激酶、核苷酸还原酶或 DNA 甲基转移酶 (DMNT)。在罕见的 NET(如副神经节瘤、嗜铬细胞瘤)中与 [ 131 I]I-MIBG 的组合以及新的非 SSTR 靶向放射性配体用于个性化治疗过程。本综述将概述正在进行的 PRRT 联合治疗的现状。
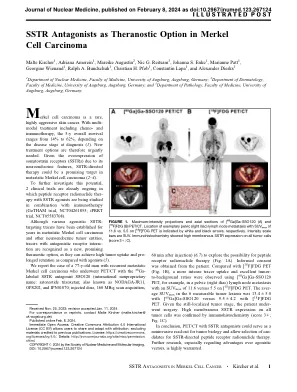
sstr拮抗剂作为默克尔细胞癌中的theranotic选择
m erkel细胞癌是一种罕见的,高度侵略性的皮肤癌。进行多模态治疗,包括化学疗法和免疫疗法,总体存活率为14%至62%,具体取决于诊断时疾病阶段(1)。因此,迫切需要新的治疗选择。鉴于生长抑素受体(SSTR)由于其神经内分泌特征的过表达,SSTR指导的治疗可能是转移性默克尔细胞癌的一个有希望的靶标(2-4)。为了进一步研究这一潜力,已经进行了2项临床试验,其中正在进行与SSTR激动剂一起研究的肽受体放射性核素疗法与免疫疗法联合研究(Gotham试验,NCT04261855; IPRRT试验,NCT055583708)。尽管已在转移性默克尔细胞癌和其他神经内分泌肿瘤实体中建立了多年的各种激动靶向示踪剂,但是具有拮抗受体相互作用的示踪剂被认为是一种新的,有前途的疗法选择,因为它们可以与高肿瘤和亲蛋白的高肿瘤和促进症状相比(5)相比(5)。我们报告了一个77岁的男人,具有复发性转移性默克尔细胞癌,与68个标记的SSTR拮抗剂SSO120进行PET/CT(国际非主体名称:Satoreotide trizoxetan:satoreotide trizoxetan;也称为Nodaga-jr11,Ops202,Ops202,ops202,和ipn010101010101070;
癌症 - 印第安纳大学印第安纳波利斯分校 ScholarWorks
摘要:胸腺上皮肿瘤 (TET) 包括胸腺瘤和胸腺癌,是一类罕见的异质性恶性肿瘤,起源于胸腺。作为免疫细胞发育的重要器官,胸腺肿瘤,尤其是胸腺瘤,常与副肿瘤性自身免疫性疾病有关。针对实体和血液系统恶性肿瘤的靶向治疗的进展已改善了患者的预后,包括疗效更好、更持久以及毒性降低。靶向治疗也已在 TET 治疗中得到研究,尽管结果大多不理想。这些包括生长抑素受体靶向治疗、KIT 和 EGFR 定向酪氨酸激酶抑制剂、表观遗传调节剂、抗血管生成药物以及针对细胞增殖和存活途径和细胞周期调节剂的药物。由于缺乏强有力的疗效生物标志物,许多研究的治疗方法都失败了或表现不佳。正在进行的试验试图扩展以前的经验,包括探索早期疾病的有效药物。新的联合治疗策略也在接受评估,目的是增强疗效和了解毒性,同时扩大疗效和安全性的生物标志物。随着技术进步,改善靶标识别和药物输送,旧靶标可能成为新的机会,随后开发的药物可能会在胸腺肿瘤的治疗中找到一席之地。
靶向癌症中的生长激素:未来的观点
胰神经内分泌肿瘤(Pannens)是罕见的相对恶性肿瘤,尽管它们经常增长,但具有转移的能力。转移性和/或晚期胰岛素瘤和葡萄糖代表正在从胰腺中涌现出pannens,这些胰腺表现出独特的特征性,具体取决于其激素综合征和增强的恶性潜力。高级胰瘤管理通常遵循Pannens治疗算法,但是有很好的建议,旨在控制降糖症,偶尔会严重且难以治疗。第一代生长抑素类似物(SSA)无法控制低血糖综合征,第二代SSA和Everolimus必须考虑利用其高血糖效应。有证据表明,依维莫司在重新保存其降血糖作用后仍然有效,独立于其抗肿瘤作用,似乎是由不同的分子途径介导的。肽受体放射性核素治疗(PRRT)构成了其抗凝聚和抗肿瘤作用的有前途的治疗选择。同样,晚期和/或转移性葡萄糖代表的管理也遵循Pannens治疗算法,但是临床综合征必须通过氨基酸输注和第一代SSA来解决,以提高患者的性能状况。PRRT似乎是一种有效的治疗方法。这些治疗方式的应用已被证明可以有效控制分泌综合征的表现,并延长患有这些恶性肿瘤的患者的总体存活率。
C-7 Cabozantinib治疗先前治疗的3级神经内分泌肿瘤(G3 NETS)的患者
结果11例(4名女性,7名男性),中位年龄61岁(范围40 - 79)符合纳入标准。七个患有胰腺原发性肿瘤;每个人都有十二指肠,小肠,直肠和未知小学的网。最初活检的KI-67中位数为15.5(范围0.89 - 55),在开始Cabozantinib之前,重复活检的51.4(范围23.4 - 97)为51.4(范围23.4 - 97)。九名患者完成了基因组研究,其中2例具有TMB> 200 m/Mb,可能是替莫唑胺诱导的高透气状态。九名患者具有先前的生长抑素类似物,有6例先前的PRRT,所有患者在开始Cabozantinib之前先前均有Captem。九名患者在卡博替尼之前接受了其他化学疗法(所有患者均具有伊立替康或奥沙利铂方案)。四名患者患有依维莫司和1名患者(TMB高)进行免疫疗法,没有反应。五名患者有客观反应,但没有一个随访的成像。九名患者进展,但有2名患者在开始治疗后不久死亡。中值MPFS为2.8个月(范围2.2 - 14),自卡博替尼开始日期的中位OS为24.5。两名患者不得不停止Cabozantinib的毒性,3例需要减少剂量。
抑郁症患者皮质微电路抑制减少的脑电图生物标志物
生长抑素表达 (SST) 中间神经元的皮质抑制减少与难治性抑郁症密切相关。然而,SST 中间神经元抑制减少对微电路活动的影响是否具有可在脑电图 (EEG) 信号中检测到的特征仍不清楚。我们使用具有正常(健康)或减少的 SST 中间神经元抑制(抑郁)的人类皮质微电路的详细模型模拟了静息状态活动和脑电图。健康微电路模型显示出静息状态脑电图的关键特征,而抑郁微电路表现出增加的 theta、alpha 和低 beta 功率(4 – 15 Hz)。抑郁症的变化涉及非周期性宽带和周期性 theta 和低 beta 成分的组合。然后,我们通过展示它们与减少的 parvalbumin 表达 (PV) 中间神经元抑制相对应的脑电图特征不同,证明了 SST 中间神经元抑制减少的脑电图特征的特异性。因此,我们的研究将 SST 中间神经元抑制水平与从详细的人类微电路模拟的 EEG 中的不同特征联系起来,这可以帮助更好地使用 EEG 识别抑郁症的机械亚型,并以非侵入性方式监测皮质抑制的调节。 通讯作者:Etay Hay 博士 Krembil 神经信息学中心,成瘾和心理健康中心 250 College St, Toronto, Ontario, M5T 1R8 电子邮件:etay.hay@camh.ca
肢端肥大症患者诱发高血糖
pasireotide是一种用于治疗厄运病的生长抑素类似物,这是由过量生长激素引起的慢性疾病。尽管对pasireotide的治疗益处是对无法充分控制的肢端肥大的二线治疗方法,但主要关注的是其高血糖副作用。在这里,我们提供了有关如何选择适当的肢端肥大症患者进行pasireotide治疗的指导。我们总结了与pasireotide相关高血糖高风险的患者的基线特征,并建议基于风险验证的监测策略。对血糖水平(SMBG)的自我监测,禁食等离子体葡萄糖(FPG)的测量值,餐后等离子体葡萄糖(PPG)和常规的HBA1C测量值是我们建议的监测方法的基础。pasireotide诱导的高血糖的病理生理学涉及降6型激素GIP(葡萄糖依赖性胰岛素多肽)和GLP-1(甘氨酸样肽-1)的分泌降低。我们的专家建议通过建议在所有适当的患者中均可在所有适当的患者中,通过建议基于君主治疗的二肽基肽-4抑制剂(DPP-4I)(DPP-4I)(DPP-4I)(DPP-4I)(DPP-4I)(DPP-4I)(DPP-4I),以所有适当的患者在适当的患者中访问了替代人,我们的专家建议涉及基于肠血蛋白诱导的高血糖的特异性病理生理学(DPP-4I)和Glucagogon-1抑制剂(GLP-1 RA)。此外,我们强调了对肢端肥大,出色的糖尿病教育,营养和生活方式指导的充分控制的重要性,并建议在pasireotide下的高血糖患者管理中不确定性的情况下咨询专家糖尿病学家。
d serine可用性调节前额叶皮层抑制性间膜间发育和电路成熟
尾脑神经元的适当发展和功能对于维持皮质回路中的激发和抑制(E/I)平衡至关重要。谷氨酸通过N-甲基-D-天冬氨酸受体(NMDARS)有助于皮质间神经元(CIN)发育。nMDAR激活需要甘氨酸或D-丝氨酸的共同激动剂的结合。d-serine(许多成熟前脑突触的共同激动剂)被L丝氨酸的神经酶丝氨酸种族酶(SR)进行了激烈。我们利用本构SR基因敲除(SR - / - )小鼠研究了D-丝氨酸的可用性对前比率皮层(PRL)中CIN和抑制突触发展的影响。我们发现最未成熟的LHX6 + CIN表示SR和强制性的NMDAR亚基NR1。在胚胎第15天,Sr - / - 小鼠在神经节象征中积累了GABA和有丝分裂增殖的增加,而E18 Neofortex中的GAD1 +(谷氨酸脱羧酶67 kDa; gad67)细胞的较少(谷氨酸脱羧酶67 kD67)。LHX6+细胞成长为白蛋白(PV+)和生长抑素(SST+)CINS。在产后日(PND)16 sr - / - 小鼠的PRL中,GAD67+和PV+的GAD67+和PV+显着下降,但SST+ CIN密度却没有显着降低,这与降低的2/3跨膜神经元的抑制性突触后潜能降低有关。这些结果表明,D丝氨酸的可用性对于产前CIN发育和产后皮质回路的成熟至关重要。
大脑、行为与免疫 - 健康 - 精神病学系
炎症、γ-氨基丁酸能 (GABAergic) 功能降低和神经可塑性改变是重度抑郁症 (MDD) 中同时发生的病理生理学。然而,这些生物学变化之间的联系仍不清楚。我们假设炎症会导致 GABAergic 中间神经元标记物缺陷,并且这种影响是由脑源性神经营养因子 (BDNF) 介导的。我们在此报告,在第一批 C57BL/6 小鼠(n = 72;10 – 11 周;50% 为雌性)中腹膜内注射脂多糖 (LPS) (0.125、0.25、0.5、1、2 mg/kg) 引起的全身炎症导致前额皮质 (PFC) 和海马 (HPC) 中的白细胞介素 1-beta 和白细胞介素-6 增加,使用酶联免疫吸附测定 (ELISA) 测量。定量实时聚合酶反应 (qPCR) 用于探索 LPS 对 GABAergic 中间神经元标志物表达的影响。在第二组 (n = 39; 10 – 11 周; 50% 为雌性) 的 PFC 中,2 mg/kg LPS 降低了生长抑素 ( Sst ) (p = 0.0014)、小白蛋白 ( Pv ) (p = 0.0257)、皮质抑素 ( Cort ) (p = 0.0003)、神经肽 Y ( Npy ) (p = 0.0033) 和胆囊收缩素 ( Cck ) (p = 0.0041) 的表达,并且不影响促皮质素释放激素 ( Crh ) 和血管活性肠肽 ( Vip ) 的表达。在 HPC 中,2 mg/kg LPS 降低了 Sst (p = 0.0543)、Cort (p = 0.0011)、Npy (p = 0.0001) 和 Cck (p < 0.0001) 的表达,但不影响 Crh 、 Pv 和 Vip 的表达。LPS 降低了 PFC (p < 0.0001) 和 HPC (p = 0.0003) 中 Bdnf 的表达,这与受影响的标志物 (Sst、Pv、Cort、Cck 和 Npy) 显着相关。总之,这些结果表明炎症可能是导致 MDD 中观察到的皮质细胞微电路 GABAergic 缺陷的因果关系。