XiaoMi-AI文件搜索系统
World File Search SystemDNA 复制的保真度
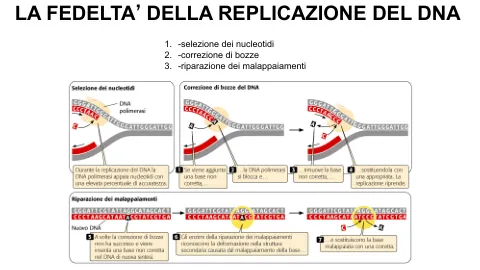
当聚合酶检测到碱基配对错误时,在 PDE 键形成后,模板-引物复合物会接近核酸外切酶域,在此消除错误的核苷酸,从而使聚合酶快速恢复合成,而不会导致整个复合物解离。
一个用于检测DNA碱基配对的ISFET微阵列传感器系统
摘要:脱氧核糖核酸(DNA)测序技术为披露遗传信息的披露提供了重要数据,并在基因诊断和基因治疗中起着重要作用。传统的测序设备很昂贵,需要大型且庞大的光学结构和其他荧光标签步骤。基于半导体芯片的测序设备具有快速测序速度,低成本和小尺寸的优点。DNA碱基配对的检测是基因测序中最重要的步骤。在这项研究中,成功设计了具有超过1300万个敏感单元的大型离子敏感的晶体管晶体管(ISFET)阵列芯片,用于检测DNA碱基配对。DNA碱基配对由传感器系统成功检测到,其中包括ISFET微阵列芯片,微流体系统和测试平台。芯片达到至少0.5 mV的高分辨率,从而识别了0.01 pH值的变化。这种互补的金属氧化物半导体(CMOS)兼容和成本效益的传感器阵列芯片,以及其他特殊设计的组件,可以形成一个完整的DNA测序系统,并具有潜在的分子生物学领域的应用。
解决siRNA药物治疗遗传病的副作用问题
“脱靶效应很可能发生在存在与 siRNA 种子区域形成碱基配对的非靶标 mRNA 时,”Hiroshi Abe 教授解释道。“我们意识到,可以通过化学修饰降低该种子区域的碱基配对能力或双链稳定性来抑制脱靶效应,确保只有当整个引导链与靶标 mRNA 结合时才能形成稳定的复合物。”
连接酶介导的具有双面 5-羧基尿嘧啶核碱基的 CuII 响应变构 DNA 酶的合成
基于互补氢键碱基配对的核酸高度复杂的分子识别能力导致了 DNA 纳米技术研究领域的迅猛发展。1 通过控制 DNA 杂交和结构以响应诸如 DNA/RNA 结合、pH 变化和光照射等刺激,已经创建了大量 DNA 纳米设备、传感器和分子机器。2 金属离子也可用作外部刺激来调节 DNA 结构和功能,特别是通过利用金属介导的非自然碱基配对。3 通过与桥接金属离子络合,两个相反的配体型核碱基类似物之间形成金属介导的人工碱基对。金属介导的碱基配对通常可以稳定 DNA 双链,从而以金属依赖的方式控制 DNA 杂交。为了通过金属络合有效地切换 DNA 功能,我们最近建立了一种新的概念,即双面 5-修饰嘧啶核碱基的金属介导碱基对切换。 4 – 7 双面碱基,如 5-羟基尿嘧啶 ( U OH ) 4,5 和 5-羧基尿嘧啶 ( caU ) 6 被设计成在金属介导的自碱基对 (例如, U OH – Gd III – U OH ) 中形成
药物基因组学 (PGx) 指南
一种通用的实验室方法,涉及将数千到数百万个已知核酸片段阵列结合到固体表面,称为“芯片”。然后将从研究样本(如细胞或组织)中分离的 DNA 或 RNA 浸泡在芯片上。样本和芯片固定片段之间的互补碱基配对通过荧光产生光,可以使用专门的机器进行检测。微阵列技术可用于研究和临床研究中的多种目的,例如测量基因表达和检测特定 DNA 序列(例如单核苷酸多态性)。
1上的RNA膜型蛋白组Michael Yarus ...
选定的核糖核苷酸序列与zwitterionic磷脂双层膜良好结合,尽管随机RNA却没有。在选定的膜结合RNA中没有明显的重复序列。这意味着负责膜亲和力的小小的和多样化的图案。此类子序列已被部分定义。绑定的RNA需要Mg 2+和/或Ca 2+之类的分隔线,更喜欢有序的磷脂:凝胶,波纹或筏膜,以此顺序。rNA还结合并稳定弯曲或急剧变形的双层。相比之下,没有二线的RNA结合扩展到由简单的阴离子磷脂形成的负电荷的膜,并具有合理的益生元脂肪酸双层。RNA膜还保留RNA功能,例如碱基配对,色氨酸的被动转运,对肽侧链(如精氨酸)的特异性亲和力以及核糖酶连接酶的催化。具有生化功能的多个膜结合的RNA,通过特定的碱基对链接。鉴于这些实验事实,遗传效应似乎是合理的。RNA的功能通常驻留在几个核苷酸中,并且很容易连接在一个小的RNA中。这些基础对基团可以演变为有目的的,连接相关的RNA函数。这样的RNA组允许复杂的基因组功能,但仅需要复制短RNA。RNA膜促进细胞分裂的精确RNA分离,并通过附加新的碱基配对功能迅速发展。因此,古代RNA-膜可以充当原始组,支持在DNA和DNA基因组之前有序编码的RNA表达,遗传和进化。
2024/25 项目
摘要:生成内部既有顺磁性掺杂又可能装载治疗剂的介孔纳米粒子,为可编程治疗诊断学提供了很大帮助。如果可以立体控制内部粒子空隙对外部溶液的暴露,那么水和药物的扩散就可以得到控制。DNA 是一种可编程的自组装材料,其中各组成部分之间相互作用的强度和特性可以使用简单的沃森-克里克碱基配对规则来设计。它可以用作治疗诊断设备的构造材料,当满足一组条件时,可以检测或释放药物和/或信号。该项目将设计、制造和表征这些可以响应与疾病状态相关的生物线索的混合纳米材料。
样本文献请参阅所附的网络链接以获取正确版本。
为了建立持续的防御系统,细菌会将每一段病毒 DNA 从间隔序列中取出,并将其转录成一条 RNA 链。这条 RNA 链被称为向导 RNA (gRNA)。Cas 酶随后与 gRNA 结合,“加载”Cas 蛋白。gRNA-Cas(通常称为 CRISPR-Cas)一起在细胞中漂移。如果它们遇到与间隔序列匹配的外来 DNA,gRNA 将与其碱基配对,Cas 酶会将入侵者的基因组切成碎片,从而阻止病毒复制(图 3)。该系统仅切割特定于 RNA 间隔序列的 DNA。因此,CRISPR-Cas 可让细菌找到任何短 DNA 序列并精确攻击它。该系统使其他细菌防御系统(如限制性酶)看起来非常原始。
核酸线框纳米结构的设计工具
在核酸纳米技术中,纳米级结构是由DNA或RNA的合理设计的链自组装的(1,2)。核酸的碱基配对特性使它们成为可编程的可编程材料,它可以使结构具有高精度和复杂性的组装,其中包括目前多达数万个核苷酸。DNA和RNA折纸(3,4)是两个强大的,广泛的设计范式,可以指导如何通过精心构成的辅助链或kisterifs sistaple staple strands-spaple-staple-staple-staple-staple-staple-staple-staple-staple-staple-staple-staple-staple-staple-staple-staple-staple-staple-staple-staple strander-s in dna s in dna s in of dna procrant-s s of dna staple strands s in dna s in''' RNA折纸中的主题)。两种方法都已用于设计各种2D形状和3D结构(5,6)。大多数当前的3D折纸设计遵循在彼此顶部包装几层螺旋螺旋或螺旋束的方法,和 /或弯曲的螺旋束如最初建议的< / div>