XiaoMi-AI文件搜索系统
World File Search System由于高速机械载荷引起的神经细胞损伤病理
成功检测和预防脑损伤取决于与潜在病理相关的细胞损伤阈值的定量识别。在此,通过将最近开发的惯性微神经流变性技术与3D体外神经组织模型相结合,我们可以量化和解决高负载速率的神经细胞的结构病理学和关键损伤应变阈值,例如在BLAST,气腔,气液或定向能量导管中遇到的高负载率。我们发现,以MAP2为特征的神经元树突状棘显示为7.3%的物理衰竭菌株,而微管和纤维肌动蛋白能够在受伤前耐受耐受的菌株(14%)。有趣的是,尽管这些关键损伤阈值与以前报道的中等和较低应变率报道的文献值相似(<100 1/s),但此处报道的原发性损伤的病理学与凋亡或坏死过程中的生物化学激活相比纯粹是物理性质的明显不同。
神经细胞在大脑发育中的转录组,衰老...
摘要:胶质细胞对于在发育,衰老和疾病期间的大脑功能至关重要。然而,星形胶质体在大脑发育过程中发挥作用与成人病变大脑中所起的作用完全不同。因此,对衰老的大脑和脑血管疾病中星形胶质细胞活性下的病理机制的更深入了解对于指导新的治疗策略的发展至关重要。为此,本综述提供了在发育,衰老和神经退行性疾病(包括脑缺血)过程中星形胶质细胞的转录组活性之间的比较。在胎儿脑发育期间,星形胶质细胞和小胶质细胞通常会影响相同的发育过程,例如神经/神经胶质发生,血管生成,轴突生长,突触发生和突触修剪。在成人大脑中,通过介导突触消除,而小胶质细胞活性与突触可塑性的变化相关,并通过不断感测环境来消除细胞碎片,而成人大脑星形胶质细胞是突触重塑的关键参与者。然而,在病变的大脑星形胶质细胞中,对神经元的能量供应,神经传递和堆积的保护性疤痕隔离病变部位,从周围环境中散发出了重要的功能。炎症,神经变性或脑稳态的丧失会诱导小胶质细胞基因表达,形态和功能的变化,通常称为“启动”小胶质细胞。基因表达的这些变化的特征是吞噬体,溶酶体和抗原表现信号传导途径的富集,并与编码细胞表面受体的基因上调有关。此外,底漆的小胶质细胞的特征是基因网络响应干扰素伽玛的上调。结论。在大脑发育,衰老和神经退行性疾病期间,星形胶质细胞转录组活性的比较可能会为我们提供新的治疗策略,以保护大脑衰老并改善临床结果。关键词:星形胶质细胞,小胶质细胞,大脑,发育,转录组学,神经变性,当前几乎无法获得衰老大脑和脑血管疾病的神经保护疗法。胶质细胞对于
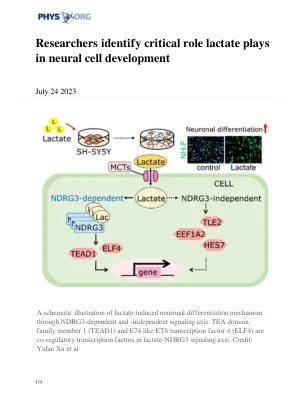
研究人员确定乳酸在神经细胞发育中的关键作用
”鉴于越来越多的证据表明乳酸在生理和病理条件下提供了各种细胞类型的信号调节功能,我们假设乳酸通过改变全面的基因表达来影响神经元功能,” Toohoku Nagatomi教授从Toohoku University的Ryoichi Nagatomi教授和研究团队研究生院以及研究团队研究生院与PH。来自东京医学和牙科大学的学生Yidan Xu和Joji Kusuyama副教授。
多种形式的神经细胞死亡在殖民脊髓脉的周期性脑变性中
1霍普金斯海军陆战队,干细胞生物学和再生医学研究所,斯坦福大学,帕特里·格罗夫,CA 93950,美国2美国2干细胞生物学和再生医学研究所,斯坦福大学医学院,斯坦福大学,加利福尼亚州斯坦福大学,加利福尼亚州94305,美国34305 Biologia, Universit à degli Studi di Padova, 35131 Padova, Italy 5 “Aldo Ravelli” Center for Neurotechnology and Experimental Brain Therapeutics, Department of Health Sciences, University of Milan, 20142 Milan, Italy 6 Department of Electronics, Information and Bioengineering, Politecnico di Milano, 20133 Milan, Italy 7 San Camillo Hospital srl, IRCCS,30126委内兹,意大利委内西亚8 Chan Zuckerberg Biohub,旧金山,加利福尼亚州94158,美国9美国94158病理学系,斯坦福大学医学院,美国加利福尼亚州斯坦福大学,美国加利福尼亚州94305); lucia.manni@unipd.it(l.m.)
ZDHHC16 通过抑制脑卒中模型中的 CREB 促进神经细胞铁死亡
引言:本研究探讨了ZDHHC16在脑卒中(CA)模型中的作用及其可能的机制。材料和方法:从我院收集CA患者。使用小鼠建立大脑中动脉闭塞(MCAO)模型。结果:CA患者的ZDHHC16水平上调。ZDHHC16上调在体外模型中促进炎症并加速线粒体损伤。ZDHHC16基因上调促进神经细胞铁死亡。抑制ZDHHC16可预防小鼠脑卒中。ZDHHC16上调通过促进CREB泛素化与CREB相互连接来抑制CREB。CREB激动剂抑制了体外模型中ZDHHC16上调的影响。 CREB 抑制剂在体外模型中抑制了 ZDHHC16 下调的影响。结论:我们得出结论,ZDHHC16 通过抑制 CREB 促进 CA 模型中的铁死亡和炎症。该发现可能对 CA 或其他神经系统疾病的治疗有益。
REST靶向人类唐氏综合症大脑和神经细胞中的JAK – Stat和HIF-1信号通路
摘要:唐氏综合症(DS)是最常见的染色体21(HSA21)非整倍性的染色体障碍,其特征是智力障碍和寿命降低。转录阻遏物,阻遏物元件1沉默转录因子(静止)是表观遗传调节剂,是神经元和神经胶质基因表达的关键调节剂。在这项研究中,我们鉴定并研究了靶标基因在人脑组织,大脑器官和神经细胞中的作用。基因表达数据集由人类脑组织,脑组织,NPC,神经元和星形胶质细胞的健康对照和DS样品产生,从基因本体论(GEO)和序列读取存档(SRA)数据库中获取。在所有数据集上进行差异表达分析,以在DS和对照组之间产生差异表达基因(DEG)。靶向的DEG进行了功能本体,途径和网络分析。我们发现,跨多个不同大脑区域,年龄和神经细胞类型的JAK-Stat和HIF-1信号通路富含DS中的REST靶向DEG。我们还鉴定了涉及神经系统发育,细胞分化,脂肪酸代谢和DS脑中炎症的重新定位的DEG。基于发现,我们建议将休息作为关键调节剂,并且是一个有前途的治疗靶标,以调节DS脑中的稳态基因表达。
皮层内微刺激脉冲波形和频率招募皮层神经元和神经细胞激活的不同时空模式
标题:皮层内微刺激脉冲波形和频率招募皮层神经元和神经纤维网激活的不同时空模式。作者:Kevin C. Stieger 1,2、James R. Eles 1、Kip A. Ludwig 3-5、Takashi DY Kozai 1,2,6-8 附属机构:1. 匹兹堡大学生物工程系,宾夕法尼亚州匹兹堡 2. 匹兹堡大学认知神经基础中心,卡内基梅隆大学,宾夕法尼亚州匹兹堡 3. 威斯康星大学麦迪逊分校生物医学工程系,威斯康星州麦迪逊 4. 威斯康星大学麦迪逊分校神经外科系,威斯康星州麦迪逊 5. 威斯康星转化神经工程研究所 (WITNe),美国威斯康星州麦迪逊 6. 匹兹堡大学神经科学中心,宾夕法尼亚州匹兹堡 7. 匹兹堡大学麦高恩再生医学研究所,宾夕法尼亚州匹兹堡 8. 匹兹堡大学脑神经技术中心宾夕法尼亚州匹兹堡研究所
BITS F464:机器学习(2024-25 年第一学期)
电信号会向大脑中的某个神经细胞发射,然后传到其他神经细胞。学习会强化这些信号所采用的路径,本质上就是在大脑中“连接”某些常见路径。
青少年/儿童心理问题
神经细胞脑内是由上亿个称为「神经元」的特殊神经细胞所组成。 神经元能接受、处理和传递讯息,以控制身体诸如说话、视觉、肌肉活动以及思考和情绪反应。
在神经细胞原发性纤毛的钙动力学调节刺猬信号传导依赖性神经发生在胚胎神经管
神经干细胞增殖与神经元分化之间的平衡对于适当发展神经系统至关重要。Sonic刺猬(SHH)依次促进细胞增殖和神经表型的规范,但是负责从有丝分裂到神经源的发育转变的信号传导机制尚不清楚。在这里,我们表明,SHH通过瞬态受体电势阳离子阳离子c构件C成员3(TRPC3)(TRPC3)通过Ca 2+涌入来增强Ca 2+的活性,并通过Ca 2+涌入发育于Ca 2+涌入,并以发育阶段相互依赖的阶段相关的方式从细胞内存储中释放。这种睫状Ca 2+的活性反过来又通过下调SOX2表达和神经源性基因的上调表达来拮抗神经干细胞中的规范,增生性SHH信号,从而实现了神经元分化。这些发现表明,神经细胞睫状信号传导中的SHH-CA 2+依赖性开关触发了SHH作用从规范有限源性到神经源的开关。在该神经源信号轴上鉴定的分子机制是治疗脑肿瘤和神经发育障碍的潜在靶标。