XiaoMi-AI文件搜索系统
World File Search System摘要公共评估报告兰索拉唑太阳...
- 对十二指肠和胃溃疡的治疗 - 食管中炎症的治疗(恢复性食管炎) - 预防对胃炎和酸反流的治疗 - 通过抗体治疗或治疗抗生素治疗 - 持续治疗 - 胃燃烧 - 胃燃烧 - 对感染的治疗 - 治疗次生治疗 - 持续治疗 - 持续治疗 - 未经治疗 - 抗炎药(NSAID)治疗(NSAID治疗用于疼痛或炎症) - Zollinger-Ellison综合征的治疗。
WS9056X 非隔离降压型LED 恒流驱动芯片 - NET
X-ON Electronics 最大的电气和电子元件供应商 点击查看 LED 显示驱动器类别的类似产品: 点击查看 Winsemi 制造商的产品: 其他 类似产品如下:
新型的抗CMET抗体Seemet 12在大肠癌模型中增强了索拉非尼治疗和放射疗法
酪氨酸 - 蛋白激酶Met(CMET),也称为肝细胞生长因子受体(HGFR),是由MET原始癌细胞编码的异二聚体跨膜酪氨酸激酶受体。CMET受体的天然配体是肝细胞生长因子(HGF),这是一种不活跃的蛋白质,通过蛋白水解裂解将其变为活性形式。与HGF结合后,CMET二聚并触发了催化域中的磷酸化,最终打开了CMET主动对接位点3。CMET激活激活了参与调节运动性,增殖和存活的多种信号转导途径,例如RAS,PI3K,STAT,Beta-catenin和Notch途径(1)。异常调节CMET(2-5)。CMET及其下游信号通路的高激活已被证明可引发过度增殖,肿瘤侵袭,血管生成,并且与存活率较差相关(6)。 各种过程,例如与其他细胞表面受体,配体刺激升高,突变和CMET受体的过表达可能刺激CMET的这种异常信号传导(1)。 除了其作为致癌驱动力的作用外,越来越多的证据表明,CMET是对化学疗法和放疗的抗性的核心因素,以及针对VEGFR和EGFR的靶向疗法。 建议的机制包括促进侵入性生长程序和/或诱导干细胞样性质,以及介导免受凋亡的保护(7-10)。 新的治疗CMET及其下游信号通路的高激活已被证明可引发过度增殖,肿瘤侵袭,血管生成,并且与存活率较差相关(6)。各种过程,例如与其他细胞表面受体,配体刺激升高,突变和CMET受体的过表达可能刺激CMET的这种异常信号传导(1)。除了其作为致癌驱动力的作用外,越来越多的证据表明,CMET是对化学疗法和放疗的抗性的核心因素,以及针对VEGFR和EGFR的靶向疗法。建议的机制包括促进侵入性生长程序和/或诱导干细胞样性质,以及介导免受凋亡的保护(7-10)。新的治疗因此,越来越多地研究了对CMET信号通路的抑制,这并不奇怪。这可能是增强现有靶向疗法以及预防或逆转耐药性的一种方法。索拉非尼耐药是一个例子,最近的研究将CMET活性视为具有重要临床意义的主要阻力因子(11,12)。Sorafenib是最近引入的小分子多激酶抑制剂,目前批准用于治疗例如晚期肾细胞癌和肝细胞癌(HCC),目前正在临床试验中用于治疗结直肠癌(13)。它抑制了参与肿瘤发生的多种激酶(RAF-1,野生型B-RAF,突变体B-RAF,C-KIT,FLT-3和RET)(14),以及促动型受体酪氨酸激酶,包括VEGFR-1/2/2/2/3,PDGFR-1/2,PDGFR-β和FGFR1。然而,在临床试验中,低和不稳定的反应率和短时间持续时间(15)表明固有的原发性和获得的次级电阻。
NEAT1–SOD2 轴通过激活肝癌细胞系中的 AKT 赋予索拉非尼和仑伐替尼耐药性
摘要:本研究探讨了长链非编码 RNA 核副斑马组装转录本 1 (NEAT1) 变体 1 (NEAT1v1) 对肝癌细胞系耐药性的影响。NEAT1 敲低激活了丝裂原活化蛋白激酶 (MAPK) 信号通路,包括 MAPK 激酶 (MEK)/细胞外信号调节激酶 (ERK),但抑制了 AKT。此外,NEAT1 敲低使肝癌细胞对索拉非尼和仑伐替尼敏感,这两种药物均在临床上用于治疗肝细胞癌,而它却使肝癌细胞对 AKT 靶向药物 capivasertib 产生耐药性。NEAT1v1 过表达抑制了 MEK/ERK 并激活了 AKT,导致对索拉非尼和仑伐替尼产生耐药性并对 capivasertib 产生敏感。超氧化物歧化酶 2 (SOD2) 敲低可逆转 NEAT1v1 过表达对分子靶向药物敏感性的影响。尽管 NEAT1 或 SOD2 敲低增强了内质网 (ER) 应激,同时抑制了 AKT,但 ER 应激抑制剂牛磺脱氧胆酸并未恢复 AKT 活性。虽然还需要进一步的体内和临床研究,但这些结果表明 NEAT1v1 通过 SOD2 将肝癌细胞系的生长模式从 MEK/ERK 依赖模式转变为 AKT 依赖模式,并独立于 ER 应激调节对分子靶向药物的敏感性。
摘要:本研究旨在探讨脂质体氯膦酸盐联合顺铂或索拉非尼对 FOXQ1 表达的影响
摘要:本研究旨在探讨氯膦酸盐脂质体联合顺铂或索拉非尼对肝癌细胞系FOXQ1表达及生物学功能的影响。采用实时定量聚合酶链式反应(qRT-PCR)检测正常肝细胞系和肝癌细胞系中FOXQ1的表达。HepG2和MHCC97H细胞分别给予低、中、高浓度的顺铂(3、5和7 μg/ml)或索拉非尼(2、7和20 μg/ml)联合氯膦酸盐脂质体(LC,20μg/ml),检测各组FOXQ1的表达。采用细胞迁移、MTT和Transwell实验检测各处理对HepG2和MHCC97H细胞生物学功能的影响。 qRT-PCR结果显示,4种肝癌细胞系中FOXQ1 mRNA表达均高于正常细胞,且在HepG2和MHCC97H细胞中FOXQ1 mRNA的表达更占优势。所有试验剂量的顺铂均下调FOXQ1表达,但仅高剂量索拉非尼下调FOXQ1表达,而低、中浓度索拉非尼对FOXQ1表达无明显影响。顺铂或索拉非尼与LC联合应用时,FOXQ1表达水平明显降低。细胞迁移、MTT和transwell实验显示,各药物单独应用时增殖、迁移和侵袭均受到抑制,但与氯膦酸盐脂质体联合应用时作用更强。脂质体氯膦酸盐联合顺铂或索拉非尼可以下调HepG2和MHCC97H肝癌细胞中FOXQ1的表达,抑制其增殖、迁移和侵袭。
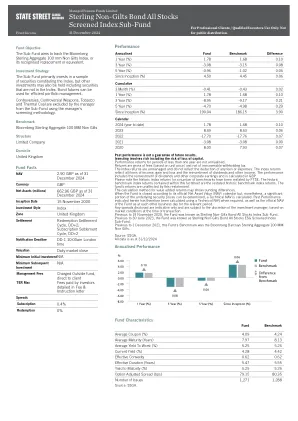
英镑的非镀金债券所有股票筛选索引子基金
过去的表现并不是未来结果的保证。投资涉及风险,包括损失资本的风险。少于一年的绩效收益不到年化。收益是总费用(基于单位价格)和无法抵消的扣除税。指数退货是不受管理的,并且不会反映任何费用或费用的扣除。指数回报反映了收入,收益和损失的所有项目,以及股息和其他收入的再投资。绩效包括股息和其他公司收益的再投资,并在英镑中进行了计算。请注意,FTSE重述了许多基准的历史索引返回。此事实说明中包含的历史基准索引回报是重述的历史基准指数回报。基金的收益不受此重述的影响。增值回报的计算方法可能显示舍入差异。当基金根据其官方净资产价值(NAV)日历关闭时,但是可以确定基本安全价格的很大一部分,则计算出技术NAV。因此,本文指定的过去的绩效是在需要时使用技术导航以及基金的官方NAV在相关期间与互助的官方NAV进行了计算的。根据交易时的市场条件,披露的任何价差仅指示,并由投资经理的酌处权。在2020年11月19日之前,该基金被称为Sterling非Gilts Bond所有股票指数子基金。在2023年6月30日之前,该基金被称为Sterling非Gilts Bond所有股票ESG筛选指数子基金。在2021年12月1日之前,该基金的基准是Bloomberg Barclays Sterming Extregate 100毫米非镀金。
采用预测性生物标志物的不同方法
可操作基因在预测索拉非尼疗效中的作用。方法:通过定量实时逆转录 PCR,我们分析了 220 例接受索拉非尼治疗的 HCC 患者的肿瘤与非癌组织中 7 种可操作基因( VEGFR2 、 PDGFRB 、 c-KIT 、 c-RAF 、 EGFR 、 mTOR 和 FGFR1 )的表达水平。我们的分析发现,与无反应者相比,9 名反应者并没有独特的临床特征。受试者操作特征曲线评估了根据可操作基因计算的治疗效益评分 (TBS) 的预测性能。结果:反应者的 TBS 值明显高于无反应者。曲线下面积为 0.779,mTOR 与 VEGFR2 、 c-KIT 和 c-RAF 相结合的 TBS 是索拉非尼疗效的最显著预测因子。索拉非尼单独使用时,HCC 患者的反应率为 0.7–3%,但当根据可操作基因对患者进行分层时,肿瘤反应率上升至 15.6%。此外,可操作基因表达与肿瘤反应显着相关。结论:我们根据可操作分子亚型对患者进行分层的研究结果可能为提高索拉非尼治疗 HCC 的有效性提供一种治疗策略。
BC癌症协议摘要用于使用阿扎西丁氨酸和索拉非尼治疗急性髓样白血病
4。药物相互作用:索拉非尼主要代谢并通过细胞色素P4503A4在肝脏中排出。必须考虑与细胞色素P4503A4相互作用剂的潜在药物相互作用。另请参见:http://medicine.iupui.edu/flockhart/table.htm 5。高血压:高血压患者在索拉非尼时应谨慎行事。需要严格的血压治疗,因为索拉非尼可能会引起高血压的快速发作。建议使用严重的高血压(大于200 mmHg收缩期或大于110 mmHg舒张压)的暂时悬浮。一旦控制高血压,就可以恢复治疗(另请参见http://www.hypertension.ca)。至少在前两个治疗周期中,患者应每天监测血压(家庭测量,GP办公室等)并保留可以在下次任命时提交给医师的血压期刊。6。乙型肝炎重新激活:有关更多详细信息,请参见SCHBV方案。
联合免疫检查点抑制剂治疗驱动基因阴性非小细胞肺癌脑 ...
这项工作得到了内蒙古自治区的自然科学基金会项目(编号2019MS08024)抽象非小细胞肺癌(NSCLC是最常见的组织学肺癌类型,在诊断时约有66%的患者中与远处转移有关。大脑是转移的常见部位,在初始诊断时,大约13%的患者在颅内受累。这严重影响了生活质量,并导致预后不良。驱动基因阳性NSCLC脑转移患者的靶向治疗可实现更好的颅内控制率;但是,使用驱动基因阴性NSCLC脑转移的患者的治疗选择有限。近年来,随着免疫疗法的扩展,免疫检查点抑制剂(ICI)已被广泛用于临床实践。ICI与放射疗法结合的治疗方式在治疗驱动基因阴性NSCLC脑转移的患者方面有望。本文回顾了敏感驱动器基因阴性NSCLC脑转移患者的放射治疗与免疫疗法的临床研究进度,目的是为可用的临床治疗方案提供参考。