XiaoMi-AI文件搜索系统
World File Search SystemR编程课程代码R编程课程代码
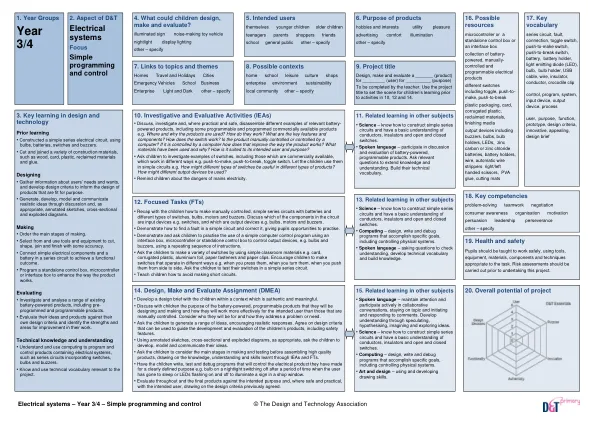
本课程旨在指导学习者通过R编程的基础知识到高级分析技术。该课程旨在迎合初学者和具有一些编程经验的人,可深入了解R的强大功能,用于统计分析,数据可视化和预测性建模。通过理论概念,动手练习和现实世界中的案例研究的融合,学习者将以对R编程及其在数据分析及其他方面的应用有强烈的理解。课程目标:
Python 和 Tkinter 编程
4.1 Tkinter 控件导览 31 Toplevel 32, Frame 33, Label 35, Button 36, Entry 37, Radiobutton 37, Checkbutton 38, Menu 39, Message 42, Text 43, Canvas 44, Scrollbar 45, Listbox 45, Scale 46 4.2 字体和颜色 47 字体描述符 47, X Window System 字体描述符 47, Colors 48, 设置应用程序范围的默认字体和颜色 49 4.3 Pmw Megawidget 导览 49 AboutDialog 50, Balloon 50, ButtonBox 51, ComboBox 52, ComboBoxDialog 53, Counter 54, CounterDialog 55, Dialog 56, EntryField 56, Group 57, LabeledWidget 58, MenuBar 59, MessageBar 59, MessageDialog 61, NoteBookR 61, NoteBookS 62, NoteBook 63, OptionMenu 64, PanedWidget 65, PromptDialog 66, RadioSelect 66, ScrolledCanvas 67, ScrolledField 68, ScrolledFrame 69, ScrolledListbox 70, ScrolledText 70, SelectionDialog 71, TextDialog 72, TimeCounter 73 4.4 创建新的 megawidget 73 megawidget 的描述 73, 选项 74, 创建 megawidget 类 74
编程指南 | Renesas
1. 本文档中包含的所有信息截至本文档发布之日均为最新信息。但是,此类信息如有更改,恕不另行通知。在购买或使用本文列出的任何瑞萨电子产品之前,请与瑞萨电子销售办事处确认最新产品信息。此外,请定期仔细关注瑞萨电子将披露的其他信息和不同信息,例如通过我们的网站披露的信息。 2. 对于因使用本文档中描述的瑞萨电子产品或技术信息而导致的或由此引起的第三方专利、版权或其他知识产权的侵权,瑞萨电子不承担任何责任。在此不授予瑞萨电子或其他方的任何专利、版权或其他知识产权的明示、暗示或其他形式的许可。 3. 您不得更改、修改、复制或以其他方式盗用任何瑞萨电子产品,无论是全部还是部分。 4. 本文档中提供的电路、软件和其他相关信息的描述仅用于说明半导体产品的操作和应用示例。您完全有责任将这些电路、软件和信息纳入您的设备设计中。瑞萨电子不承担您或第三方因使用这些电路而遭受的任何损失的责任,因此
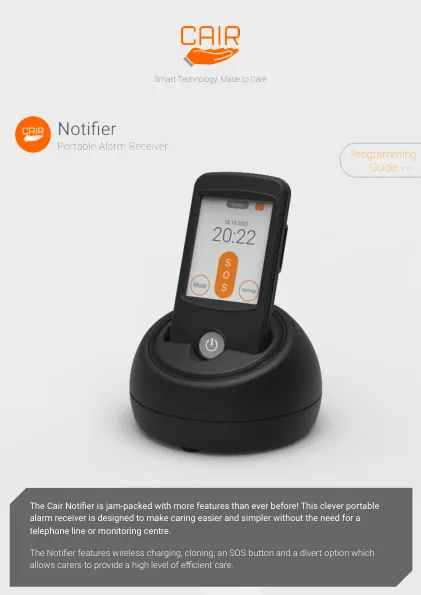
Notifier编程指南
1。将迷你USB插入充电底座的后部,然后将USB插入电源,然后将USB电源插入电气插座中。充电基地中的琥珀色LED将亮起,不久后三遍灰烬,然后熄灭。2。将Notifier放入充电基础中。在几秒钟内,将听到哔哔声,并且充电状态将从“准备就绪”变为“充电”,然后,如果打开Notifier,则屏幕将进入待机。3。当电池较低时,Notifier将需要长达2.5小时才能充分充电。如果关闭了Notifier,则不会有通知,尽管它会充电。第8页提供了有关电池充电过程的更多信息。4。充电底座应放置在通风空间中,远离可易光的材料或热源,例如散热器,直射阳光,加热器和电气设备。要确保最佳的无线电覆盖范围,请避免将充电底座放在由金属或设备制成的物体上或附近,这些物体或设备可能导致无线电干扰,例如填充柜,电视,无线电,Wi-Fi路由器,手机和计算机。5。遵循本指南,以获取有关如何将设备与Notifier配对的信息,并根据所需的首选项自定义设置。
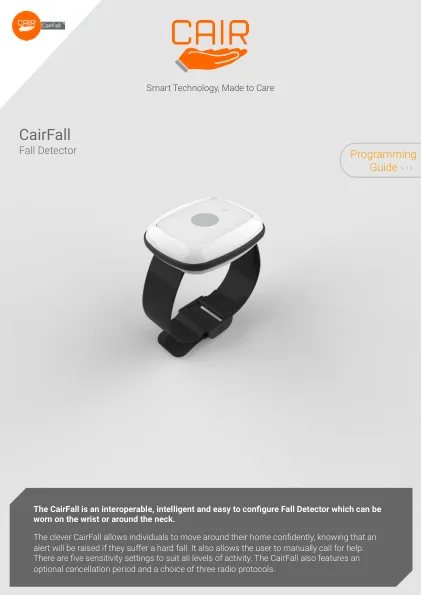
Cairfall编程指南
Cairfall具有5个灵敏度水平。1级是最敏感的,5级是最敏感的。默认值为3级。作为一般规则,为了减少虚假警报的可能性,应与更活跃的用户和最敏感的水平一起使用敏感级别,而活跃的个体较少。,如果用户不管有多么活跃都会经历错误警报,则应将灵敏度水平调整为最小敏感水平,最好一次增加一个增量,直到达到理想水平为止。相反的情况也是如此 - 如果水平不太敏感,请将其调整为更敏感的水平。
Vertex vx-150 编程
Vertex Standard 编程软件允许用户通过设置频率、功能和参数来定制他们的 Vertex 无线电。该软件与 Windows 操作系统兼容,并允许用户:* 设置频道频率和隐私代码* 为无线电上的可编程键分配功能* 配置超时计时器和其他功能的延迟时间* 保存设置并使用相同配置对多个无线电进行编程注意:FIF-10 电缆已停产并由 FIF-12 取代。在线指南可帮助用户确定其特定无线电型号所需的 Vertex Standard 编程软件和必要的编程电缆。用户还可以获得所有 Vertex Land Mobile 无线电的可下载软件副本。必须注意的是,操作某些频率需要 FCC 许可证,如果发生未经许可的传输,可能会受到严厉处罚。YAESU 提供在订购无线电时免费获得许可证的帮助。如果只有 12 至 16 伏直流电源可用,则可选的 E-DC-5B 或 E-DC-6 直流适配器可用于为电池充电。 FNB-V57 高容量电池不能使用 NC-72 充电;相反,请使用 CD-16。为了抵抗互调型干扰,请在通向基站的同轴线上安装合适的 144-148 MHz 带通滤波器。如果您使用的是“B”版本(在欧洲),请按 T-CALL 开关以发送 1750 Hz 音调,以访问需要它的中继器。必要时,按 [VFO (PRI)] 按钮选择 VFO 模式。VX-150 有两个 VFO,分别标记为“A”和“B”,可用于本手册中描述的所有程序。ARS 功能可在调谐到标准中继器子带时提供中继器发射频率的偏移。启用后,将显示一个小的“-”或“+”,表示中继器偏移处于活动状态,关闭即按即说开关会将显示更改为(偏移的)发射频率。可以锁定 VX-150 的各个按键和开关,以防止意外更改频率或无意传输。接收省电模式使无线电设备在一段时间内处于休眠状态,然后定期将其唤醒以检查活动。如果有人在该频道上讲话,VX-150 将保持“活动”模式,然后恢复其“休眠”(正常)省电模式操作。当上次收到的信号非常强时,发射省电模式会自动降低功率输出水平。使用发射省电模式,自动选择低功率操作可显著节省电池消耗。VX-150 能够测量当前电池电压。按 [F] 键,然后按 [0 (SET)] 键进入设置模式。旋转 DIAL 选择菜单项 #37(“电池电量”)。按 [VFO (PRI)] 按钮可随时更改 VFO。只要调谐到标准中继器子带,ARS 就会提供中继器偏移发射频率。启用后,将显示一个小的“-”或“+”,表示中继器偏移处于活动状态。可能的锁定组合为: - 仅锁定前面板按键... - 参见第 18 页。VX-150 的一个重要功能是其接收省电模式,该模式可“使无线电设备休眠”一段时间,并定期“唤醒”以检查活动。如果有人在频道上讲话,VX-150 将保持“活动”模式,然后恢复其“休眠”...(正常)省电操作。VX-150 还包括一个有用的发射省电模式,当最后收到的信号非常强时,它将自动降低功率输出水平。使用发射省电模式,自动选择低功耗操作可显著节省电池消耗。VX-150 能够测量当前电池电压。按[F]键,然后按[0 (SET)]键进入设置模式。旋转 DIAL 选择菜单项 #37(“... 编程默认 VX-150 设置模式已在工厂分配给 [7 (P1)] 和 [8 (P2)] 键。如果要为键定义另一种设置模式,用户可以更改这些设置。完成选择后,按 PTT 键保存新设置并退出正常操作。 VX-150 有两个 VFO,分别标记为“A”和“B”,其中任何一个都可以用于本手册中描述的所有程序。您可以随时使用 [VFO (PRI)] 按钮更改 VFO。 基本操作 VX-150 中的 ARS(自动中继器异频)功能可在您调谐到标准中继器子带时提供中继器异频发射频率(见下图)。启用后,显示屏左上角将显示一个小的“-”或“+”,表示中继器异频处于活动状态,并关闭即按即说开关将显示更改为(移位的)发射频率。为了防止意外的频率更改或无意的发射,VX-150 的各个按键和开关可能被锁定。可能的锁定组合是:仅前面板按键被锁定... 请参阅第 18 页。VX-150 无线电允许各种存储信道设置,包括主信道和五组频带边缘存储器。要调用特定的存储信道,请在选择它后短暂按下 MR(跳过)键。在 CTCSS 解码或 DCS 操作期间,可以通过设置 VX-150 以在来电时用铃声提醒您来激活“铃声”。无线电的扫描功能使您能够扫描存储信道、整个操作频带或该频带的一部分。它会在遇到信号时停止,允许您与该频率上的电台通话。在扫描之前,选择扫描仪在信号上停止后应如何恢复扫描。此外,VX-150 还具有在扫描仪在信号上停止时自动点亮 LCD 灯的功能。可以按 [F] 键,然后按 [0 (SET)] 键进入设置模式,然后选择所需设置,以禁用扫描灯。该电台的扫描功能还包括双通道扫描功能,让您可以在 VFO 或记忆信道上操作,同时定期检查用户可选择的优先信道是否活动。要激活此功能,请按 [F] 键,然后按住 [VFO (PRI)] 键。此外,VX-150 的 16 键键盘提供 DTMF 操作,可轻松拨号以进行自动补丁或中继器控制。键盘包括数字,以及常用于中继器控制的音调。最后,无线电的 CW IDENTIFIER SETUP 允许您设置 CW ID 功能,方法是按 [F] 键启用此菜单项的更改,然后旋转 DIAL 选择所需的设置。操作年度 VX-150 分组 TNC 操作说明和重置 VX-150 无线电可用于分组操作,配有可选的 CT-44 麦克风适配器,可通过常用连接器或构建自定义电缆轻松连接到 TNC。便捷的“克隆”功能允许将内存和配置数据从一个收发器传输到另一个收发器,这在公共服务操作中很有用。要激活设置模式:按 [F] 键,然后按 [0 (SET)] 键,使用 DIAL 选择菜单项编号,然后根据需要进行调整。设置: * 设置模式选项:5/10/12.5/15/20/25/50 kHz * 默认值取决于对讲机版本 * 恢复功能:+ 可用值:5 秒/忙碌/保持 + 默认值:5 秒 * ARTS 轮询间隔:15 秒/25 秒(默认值:15 秒) * 键盘蜂鸣器:开/关(默认值:开) * 繁忙信道锁定:开/关(默认值:关) 其他设置: * 超时计时器:关/1 分钟/2.5 分钟/5 分钟/10 分钟(默认值:关) * CW 标识符:编程并激活以用于 ARTS 操作 * 智能搜索:按照第 23 页的详细说明激活该功能 * 电源电压指示器:按 [F] 键,然后按 PTT 键退出正常操作 注意: * 未经 Yaesu Musen 批准的更改或修改可能会使操作此设备的授权失效。 * 本设备符合 FCC 规则第 15 部分。要进行调整或设置特定音频频率:按住 F 键并将主拨盘转到所需设置。按 PTT 按钮保存。如果您需要设置 PL 音频,请在按下 F 键后快速按下 1/SQ TYP 键,然后旋转直到出现 TN ENC。接下来,按住 F 键,然后按下 2/CODE 键,并将拨盘调整到您喜欢的音频频率。要将其存储在内存信道中:按照设置频率及其设置的步骤操作,然后按住 F 键一秒钟,然后旋转拨盘以选择内存插槽号并保存。要访问存储的频率或扫描这些频率,请按 MR/SKIP 键进入 MR 模式。选择所需的存储频道或在 MR 模式下短暂按住其中一个 MHz 键以开始扫描已保存的频道。按 PTT 停止扫描,然后使用 F 键,然后按 MR/SKIP 键暂时跳过不需要的频道。要取消跳过频道,请重复此过程。
MTR:编程说明
自购买之日起,该产品必须向消费者提供一年的材料和工艺缺陷。此保修适用于新设备的第一零售买家。保修期将修理或选择替换其在此保修下需要服务的任何设备,并将以保修人的费用将已修复或更换的设备退还给消费者。有关保修服务和运输说明的信息,请通过下面的地址与保修期联系。必须以所有者费用将设备发送给担保人进行服务。本保修提供的补救措施是独家的。根据州法律,隐含的担保是本书面保修的一年。 某些状态不允许限制隐含保修持续时间,因此上述限制可能不适用于您。 为了受到此保修的保护,请保存您的购买证明并使用设备发送副本。 此保修赋予您特定的合法权利,您也可能拥有各州各不相同的其他权利。 所有用于保修服务的产品都需要退货产品授权号码(RPA#)。 有关RPA#和其他重要详细信息,请致电1-800-543-1236与线性技术服务联系。隐含的担保是本书面保修的一年。某些状态不允许限制隐含保修持续时间,因此上述限制可能不适用于您。为了受到此保修的保护,请保存您的购买证明并使用设备发送副本。此保修赋予您特定的合法权利,您也可能拥有各州各不相同的其他权利。所有用于保修服务的产品都需要退货产品授权号码(RPA#)。有关RPA#和其他重要详细信息,请致电1-800-543-1236与线性技术服务联系。