XiaoMi-AI文件搜索系统
World File Search System阿尔茨海默病早期阶段脑容量与视网膜厚度的关系
从病理学角度来看,AD 的特征是细胞外淀粉样β蛋白 (A β ) 肽斑块和过度磷酸化的 tau 在脑内积聚,形成细胞内神经原纤维缠结 [3]。A β 在脑内沉积是在患者出现症状之前的许多年里逐渐发生的。研究还表明,A β 在脑内沉积的同时,也在视网膜上沉积 [4–7]。随着 MRI 和 PET 扫描等神经影像技术的进步,现在可以绘制和量化 A β 沉积物,这有助于在出现 AD 特征性症状之前识别临床前 AD 病例 [8]。针对 AD 中 A β 沉积物的治疗研究迄今为止尚未成功,这可能是因为在做出临床诊断时,神经退行性病变已在进行中,并且不太可能逆转 [3]。使用 MRI 或 PET 成像技术筛查 AD 面临多项挑战。成像技术既昂贵又耗时。此外,PET 使用放射性示踪剂来检测 AD 病理,这使得它无法用于人群筛查。因此,迫切需要更便宜、非侵入性的方法来筛查有患 AD 和 AD 风险的人。
通过单量子比特解缠学习量子相位
识别物质的相位具有相当大的挑战性,特别是在量子理论领域,因为基态的复杂性似乎随着系统规模的增大而呈指数增长。量子多体系统表现出一系列跨越不同相位的复杂纠缠结构。尽管已经有大量研究探索了量子相变和量子纠缠之间的关系,但在它们之间建立直接、实用的联系仍然是一个关键挑战。在这项工作中,我们提出了一种新颖、高效的量子相变分类器,利用强化学习优化的变分量子电路进行解纠缠。我们证明了该方法对横向场伊辛模型 (TFIM) 和 XXZ 模型中量子相变的有效性。此外,我们观察到该算法能够学习与 TFIM 中的纠缠结构有关的 Kramers-Wannier 对偶。我们的方法不仅可以根据解缠结电路的性能识别相变,而且还具有出色的可扩展性,有助于将其应用于更大、更复杂的量子系统。这项研究揭示了通过量子多体系统中固有的纠缠结构来表征量子相。
人工智能在阿尔茨海默病诊断中的应用前景
确定疾病存在 [1] 的洞察力。生物医学数据正在以前所未有的速度生成。生物医学科学家和临床医生都需要使用高性能计算、生物信息学和云存储,以有意义的方式高效、准确地分析这些数据。处理大型数据集的现代问题需要人工智能的现代解决方案,特别是利用人工智能的深度学习子学科。围绕人工智能(包括机器学习和深度学习)的普遍兴趣在近代历史上经历了急剧上升,因为它有望彻底改变医疗保健 [2] 。然而,已经澄清的是,“人工智能不会取代放射科医生,但使用人工智能的放射科医生将取代不使用人工智能的放射科医生” [3] 。迫切需要对患有神经退行性疾病的人进行早期诊断。到做出诊断时,中枢神经系统的损伤程度已无法修复。事实反复证明,预防神经退行性疾病的最佳方法是及早采取行动,而这只有通过早期诊断才能实现 [4] 。由于 AD 在人群中发病率高、社会负担重、无症状的临床前期长,早期诊断对于扭转疾病的趋势至关重要 [5] 。目前,AD 的诊断依据是临床表现为认知和记忆缺陷,以及组织病理学上存在混合蛋白病。AD 诊断所需的生物标志物包括 β-淀粉样斑块和由过度磷酸化的 tau 组成的神经原纤维缠结 [6] [7] 。通过影像、血液或脑脊液 (CSF) 分析结合组织学标志物,有助于明确区分轻度认知障碍 (MCI)、AD 的各个阶段或其他形式的痴呆症,例如路易体痴呆或额颞痴呆 [8] [9] [10] 。非侵入性或微创成像已成为 AD 诊断发展中的宝贵资产。例如,β-淀粉样斑块的 PET 扫描需要注射专门的放射性标记示踪剂,例如 florbetapir [11] 。PET 扫描用于 AD 诊断已被证明具有至少 96% 的敏感性和 100% 的特异性,即使对于较轻微的疾病形式也是如此 [7] 。然而,MRI 扫描仅使用磁场和无线电波进行成像。此外,脑成像提供了一种侵入性较小的方法尽管 PET 成像已获得 FDA 批准多年,并且具有很高的诊断准确性,但由于成本高昂以及患者对使用放射性标记示踪剂的担忧,它尚未成为标准的临床实践。因此,MRI 不使用计算机断层扫描 (CT) 所用的 X 射线,也不使用 PET 扫描所用的放射性标记示踪剂。但是,对于某些不能暴露于强磁波的患者(例如装有心脏起搏器或动脉瘤夹的患者),MRI 是不切实际的。MRI 可以准确检测 AD 患者的皮质萎缩模式、心室扩大、β-淀粉样斑块和神经原纤维缠结的存在和密度 [12] [13] 。
8.01.52干细胞疗法的骨科应用(...
适应于表6,Jack等人(2018)8仅适用于阿尔茨海默氏症连续体中的个体中的1个生物标志物中的1个:1)a+t+n+2)a+t-n- 3)a+t-n- 3)a+t+t+n- 4)a+t-n+t-t-n+a+t-n+,其中a:aβ或相关的aβ或相关的病理状态42 /amm am ampaβ或am am am ab ab ab ab ab aβ或相关的ab ab aβ42β42或A. 42,或A. 42,或A. 42; PET),T:总tau(神经原纤维缠结)或相关的病理状态(CSF磷酸化的tau或tau PET)和N:神经退行性或神经退行性损伤或神经退行性损伤(解剖学MRI,FDG PET或CSF PET或CSF总TAU)在第1至6阶段的阶段1至6:不需要调节的情况下,可以选择与正常的调整有关的调整,并选择(或不适合调节)。性,教育等第2至6阶段:尽管认知是核心特征,但神经行为的变化(例如,情绪,焦虑或动机的变化)可能并存。在第3至6阶段:认知障碍的特征是主要不是动荡的。CSF:脑脊液; FDG:氟脱氧葡萄糖; MCI:轻度认知障碍; MRI:磁共振成像;宠物:正电子发射断层扫描。
SiR-DNA/SiR–Hoechst诱导的染色体...
SiR-DNA/SiR – Hoechst 是一种远红荧光 DNA 探针,常用于对间期细胞核和有丝分裂期间的染色体进行活细胞成像。尽管有报道称 SiR-DNA 会引起 DNA 损伤,但它已在 300 多篇研究文章中使用,涵盖有丝分裂、染色质生物学、癌症研究、细胞骨架研究和 DNA 损伤反应等主题。在这里,我们使用活细胞成像对 SiR-DNA 对四种人类细胞系(RPE-1、DLD-1、HeLa 和 U2OS)有丝分裂的影响进行了全面分析。我们报告了 SiR-DNA 对染色体分离的剂量、时间和光依赖性影响。我们发现,在成像过程中暴露于光线下时,纳摩尔浓度的 SiR-DNA 会诱发非着丝粒染色体缠结,严重影响后期姐妹染色单体分离和纺锤体伸长。这会导致 DNA 损伤,并传递到下一个细胞周期,从而对基因组完整性产生不利影响。我们的研究结果突出了使用 SiR-DNA 研究晚期有丝分裂事件和 DNA 损伤相关主题的缺点,并敦促使用替代标记策略来研究这些过程。
基于直方图的特征跟踪阿尔茨海默氏症的进展...
阿尔茨海默氏病是淀粉样蛋白斑块,神经原纤维缠结和神经元变性的一种普通痴呆形式。该疾病无法治愈,早期发现对于改善患者预后至关重要。磁共振成像(MRI)对于测量疾病期间的神经退行性很重要。计算机辅助图像处理工具已用于帮助医疗专业人员在早期阶段确定对阿尔茨海默氏症的诊断。作为非痴呆症阶段的特征,跟踪进展是具有挑战性的。我们的工作基于平滑直方图的形态开发了一种自适应多阈值算法,以定义识别神经变性的特征,并将其进展为非,非常温和,轻度和中等。灰色和白色物质体积,统计矩,多阈值,收缩,灰白物质比以及三个距离和角度值是数学得出的。决策树,判别分析,幼稚的贝叶斯,SVM,KNN,集合和神经网络分类器旨在以性能指标的准确性,召回度,特异性,精度,F1分数,Matthew的相关系数和KAPPA值来评估所提出的方法。实验结果表明,所提出的特征成功地标记了神经变性阶段。
此项目是:
引入含有β-淀粉样蛋白(Aβ)和神经原纤维缠结(NFTS)的聚集淀粉样蛋白斑的沉积物是由高磷酸化的TAU(PTAU)组成的,是阿尔茨海默氏病(AD)的主要神经病理学特征。aβ的沉积之前是NFT在所有形式的AD,5和稀有遗传形式的疾病中的沉积之前,是由于突变的(AD-MUT)基因促进毒性Aβ在大脑中的沉积。因此,一个明显的假设是Aβ对于所有AD的启动和进展至关重要。虽然Aβ沉积显然起着重要作用,但缺乏启动和/或维持AD发病机理的证据。例如,表达一种或什至几个人类AD转基因的实验动物保证其人类10载体中的AD无法表现出强大的神经变性或NFT(1-3)。导致数百项失败的临床试验,仅在最近的一些试验中才显示出适度的临床疗效,有时甚至是有争议的临床疗效(4)。最后,多达三分之一的老年人具有足以诊断为AD诊断的Aβ沉积,但在认知上是正常的,并且可能仍然如此(5)。这些发现表明Aβ需要不同的共同因素15
使用透明的光电神经元阵列宽带非线性调制
抗淀粉样蛋白疗法,包括lecanemab,是阿尔茨海默氏病(AD)的新紧急治疗方法,其重点是从大脑中去除淀粉样蛋白β。AD具有复杂的病理生理学,其特征在于突触失调和淀粉样蛋白β的斑块和含有神经原纤维缠结的斑块的存在[1]。淀粉样蛋白Aβ肽是由淀粉样蛋白前体蛋白(APP)的切割形成的,即神经元突触中的跨膜蛋白,通过β泌尿蛋白酶和γ泌尿酶[1,2]形成。随后将其分泌为Aβ单体进入细胞外空间,该空间具有聚集的偏见,形成可溶性低聚物,原纤维,然后形成斑块[1,3]。Aβ清除率部分通过载脂蛋白E(APOE)进行了调节,该载脂蛋白E(APOE)由APOE基因编码[4,5]。apoE具有三个不同的等位基因的多态性,它们编码三个同工型:E2,E3和E4。APOE4等位基因的存在与基因剂量依赖性AD风险和更早的发作有关,并且发现APOE4的存在与Aβ的清除较慢有关,因此,APOE3和APOE3,然后是APOE2的较早和更高的Aβ积累[4,5]。
酒精和压力曝光 - 雅典 - 艾尔 - ...
阿尔茨海默氏病(AD)目前是美国第六大死亡原因(Skaria,2022年),预计未来几十年的诊断率会增加一倍(阿尔茨海默氏病的事实和图,2022年)。AD的临床诊断可以包括一系列主要至轻微的神经认知障碍,具体取决于症状(包括认知能力下降,与对认知正式评估的平均值一到两个标准偏差)干扰一个人独立生活的能力(诊断性和统计手册的心理障碍手册,20233)。AD具有明显的遗传危险因素,并且已经确定了淀粉样蛋白β肽(Aβ)聚集和神经原纤维缠结等疾病的某些病原标志物,但它仍然具有主要未解决的脑疾病(Goedert和Spillantini,2006年)。在美国,卫生与公共服务部(HHS)制定了一项国家计划,以六个总体目标解决阿尔茨海默氏病(2023年),以防止未来的AD和认知能力下降,并更好地服务于应对AD和相关dementias(ADRD)的家庭。该计划包括促进健康的衰老和减少ADRD的风险因素的重点。但是,完成此
材料化学 A - RSC 出版
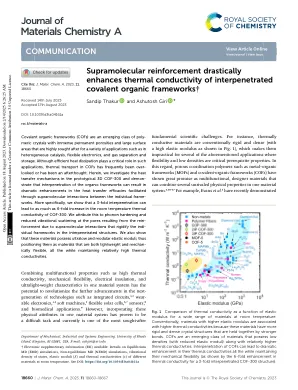
硼酸酯连接的 2D COF 薄膜具有低介电常数,室温下沿层状孔隙的热导率为 ∼ 1 W m − 1 K − 1(图 1),标志着材料设计的新范式,该范式结合了相对较高的热导率和较低的质量密度。在此,我们通过证明 3D COF 的相互渗透通过超分子相互作用显着提高其热导率,同时保持其低弹性模量,进一步增强了 COF 的卓越属性。这将互穿 COF 定位为具有机械柔性和导热性的轻质材料,这种物理特性的组合通常在大多数材料系统中都找不到,如图 1 所示。尽管过去已经合成了互穿或缠结的 3D COF 网络,18 – 23 但尚未研究交织多个 COF 晶格对所得物理特性(例如其机械和热特性)的影响。这与它们的近亲 MOF 形成了鲜明对比,在 MOF 中,互穿的影响不仅被证明会导致复杂结构的形成,24 – 27 而且与单个 MOF 晶格相比,还与增强的稳定性、增加的结构柔性和更高的气体吸附有关。28,29 此外,理想化的 MOF 的互穿还被证明可以通过额外的传热通道来提高其热导率。 30,31