XiaoMi-AI文件搜索系统
World File Search SystemDES-γ-羧基凝血酶蛋白在肝细胞癌后术后复发风险评估
背景虽然DES -γ-羧基凝血酶蛋白在肝细胞癌诊断中的诊断中的价值已被广泛认可,但是否可以将DES -γ-羧基辅助凝结蛋白用于复发评估,这在很大程度上仍未得到探索。方法我们进行了多中心回顾性分析,包括探索队列(1074例患者,5133例DES -γ-羧基辅助蛋白蛋白测量值)和验证组(263例患者,612例,612例DES -γ-γ-碳纤维蛋白测量值),以调查Des -γ-γ-碳辅助剂是否可以评估患者是否可以评估。我们引入了DES -γ-羧基凝血酶动态速率,作为DES -γ-羧基凝血酶动态变化的归一化定量测量。des-γ-羧基凝血酶蛋白动态率进一步应用于高风险的肝肝硬化患者队列(Precar coohort,542个肝肝硬化患者,2023 DES-γ-γ-羧基辅助凝固蛋白测量值)。在这里的结果,我们在勘探队列中显示了DES-γ-羧基凝血蛋白的术后减少,这使得诊断不适合诊断的DES-γ-γ-羧基凝血蛋白阈值,而DES-γ-γ-氨基辅助辅助型原抗凝血酶动态率有明显的重复依赖性。根据DES-γ-羧基凝血酶原动力率和最终浓度对患者进行分类,表明患者均表现出最佳的中值无复发生存率,并且患者的患者呈阳性,这两者都表现出最差的无复发生存期。与恢复为阴性的患者相比,始终如一的正状态患者的无复发生存率明显较低。 这些发现在验证队列中已验证。与恢复为阴性的患者相比,始终如一的正状态患者的无复发生存率明显较低。这些发现在验证队列中已验证。此外,prect precar群中的DES -γ-羧基凝血酶蛋白动态率可以识别出额外的28%的肝硬化患者,发展为肝细胞癌。结论这些结果扩展了肝细胞癌诊断生物标志物,DES -γ-羧基辅助凝血酶,通过提出对DES -γ -γ-碳二羧基凝血酶动力学的定量测量,以监测肝细胞脑脑瘤的复发,通过提议进行定量测量测量。这种测量不限于预后,还可以提高早期肝细胞癌筛查的敏感性。
在DMDMDX大鼠模型中,对心脏和骨骼肌中微型障碍蛋白基因治疗的肌营养不良蛋白羧基末端结构域的评估
引言 - 肌肉指导的基因疗法迅速引起注意,主要是因为肌肉是易于访问的目标组织,并且也与各种严重的遗传疾病有关。几种血清型的重组腺相关病毒(RAAV)向量的局部和全身传递导致骨骼和心脏肌肉的有效转导非常有效,这在小动物以及人类中都实现了。肌肉是许多肌肉营养不良疾病的基因治疗中的靶组织,也可以被用作生物疗法,以产生全身性疾病的分泌因素。使用RAAV进行肌肉基因转移的当前局限性包括载体尺寸限制,诸如靶向毒性的潜在安全问题以及既有中和的中和抗体的免疫屏障组成,以及针对人类AAV Capsid的CD8 + T细胞反应。
对称羧基中的来宾主持人互动
在这项工作中,在介孔TiO 2层(宿主)的敏化中研究了脱氧胆酸(DCA)作为coadsorbent的作用,其对称的羧基硫胺氰胺染料(来宾)。不同的方法,旨在减少H-聚集并最大程度地减少宿主活性位点的氰氨酸分子和DCA之间的竞争,从而改善太阳能电池的效率。含有羧基锚固组的亨氏丁胺的产量良好。氰烷在甲醇和二甲醇和二甲基甲酰胺溶液中的紫外线吸收归因于完全允许的电子跃迁(1ππ∗),以及NIR地区的荧光发射,在地面和激发状态下都有任何聚集的证据。TD-DFT计算,以研究这些化合物在其地面和激发电子状态中的几何和电荷分布。固态光体物理学表明,氰基在TIO 2上表现出极好的吸附,这可以通过结构中的-COOH部分的存在来证明。光物理测量结果表明,染料和DCA的最佳浓度,这导致了TiO 2表面上氰氨基H-聚集的有效抑制,此外还允许大染料负荷。通过循环伏安法鉴定染料的同性恋和Lumo能级,在染料敏化太阳能电池(DSSC)中,基于TIO 2介孔光阳极在染料敏化的太阳能电池(DSSC)中,在可接受的限制内显示氧化和还原电位。组装的DSSC已显示出电气参数和效率的大幅度改善。
羧基化的假心态优化18A213O1
众所周知,摘要超过70%的地球海洋可以覆盖地球表面。高生物多样性使海洋成为束缚中的微生物的栖息地。上衣可以与其他微生物(例如羧基化的羧基动物)相关联,以便它们可以产生包括抗生素,农药和抗肿瘤在内的生物活性化合物。鉴定生物活性化合物的初始阶段是通过分离DNA。本研究旨在使用Promega和Qiagen提取试剂盒确定细菌DNA提取的优化。这项研究包括3种治疗方法,即恢复活力,细菌鉴定和浓度测量。结果表明,使用Qiagen提取试剂盒的优化相对较高,在1,989 ng/µl -2,000 ng/µl时,使用1小时。在优化Promega提取时,所产生的纯度为1,500 ng/µl -1,943 ng/µl,处理时间为2小时。关键字:pusigate,伪心电羧基化剂,Promega提取套件,Qiagen提取套件。
连接酶介导的具有双面 5-羧基尿嘧啶核碱基的 CuII 响应变构 DNA 酶的合成
基于互补氢键碱基配对的核酸高度复杂的分子识别能力导致了 DNA 纳米技术研究领域的迅猛发展。1 通过控制 DNA 杂交和结构以响应诸如 DNA/RNA 结合、pH 变化和光照射等刺激,已经创建了大量 DNA 纳米设备、传感器和分子机器。2 金属离子也可用作外部刺激来调节 DNA 结构和功能,特别是通过利用金属介导的非自然碱基配对。3 通过与桥接金属离子络合,两个相反的配体型核碱基类似物之间形成金属介导的人工碱基对。金属介导的碱基配对通常可以稳定 DNA 双链,从而以金属依赖的方式控制 DNA 杂交。为了通过金属络合有效地切换 DNA 功能,我们最近建立了一种新的概念,即双面 5-修饰嘧啶核碱基的金属介导碱基对切换。 4 – 7 双面碱基,如 5-羟基尿嘧啶 ( U OH ) 4,5 和 5-羧基尿嘧啶 ( caU ) 6 被设计成在金属介导的自碱基对 (例如, U OH – Gd III – U OH ) 中形成
化学蛋白质组学揭示 USP5(泛素羧基...
摘要:基于质谱的有限蛋白水解化学蛋白质组学方法已成为识别和分析小分子 (SM) 与其蛋白质靶标之间相互作用的有力工具。Gracilioether A (GeA) 是一种从海绵中分离出来的聚酮化合物,我们旨在利用这种策略追踪其相互作用组。DARTS(药物亲和力响应靶标稳定性)和 t-LiP-MS(靶向有限蛋白水解质谱)代表了本研究中使用的主要技术。DARTS 应用于 HeLa 细胞裂解物以识别 GeA 靶蛋白,并使用 t-LiP-MS 研究蛋白质与 GeA 结合的区域。通过使用表面等离子体共振 (SPR) 的结合研究和计算机分子对接实验,结果得到了补充。泛素羧基末端水解酶 5 (USP5) 被确定为 GeA 的一个有希望的靶点,并解释了 USP5-GeA 复合物的相互作用特征。USP5 是一种参与蛋白质代谢途径的酶,通过将降解蛋白质上的多泛素链分解为泛素单体。这种活性与不同的细胞功能有关,包括染色质结构和受体的维持、异常蛋白质的降解和致癌进展。在此基础上,这些结构信息为后续研究开辟了道路,重点是确定 Gracilioether A 的生物学潜力以及基于新结构骨架合理开发新型 USP5 抑制剂。
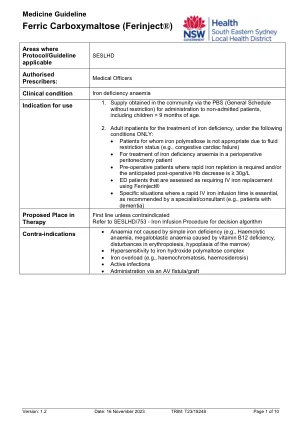
医学指南 - 铁羧基糖(FerInject)
•基线观测值应记录在输液开始后5分钟和输注结束后的5分钟。•在输注期间和输注完成后30分钟内,必须观察到患者的患者。•监视患者在给药期间的渗出迹象。铁输注可能会导致疼痛,炎症,组织坏死,无菌脓肿和特定于孕妇皮肤产假的永久性棕色变色,胎儿心动过缓很少发生。对产前女性的胎儿心脏监测 - 开学和结论时间歇性发作是足够的,除非所有怀孕和产后妇女的其他危险因素,否则EMR标准产妇观察图(SMOC)必须完成。在输液开始时与女性保持联系,并在基线和铁输注期间每30分钟进行标准观察。有关更多详细信息,请参阅特定网站的工作场所说明。儿科患者:血压,脉搏和呼吸率:
从微生物鉴定出的大型保守的小分子羧基甲基转移酶
小分子羧基甲基转移酶(CBMT)对于调节生物学过程至关重要,并且在工业生物技术中非常有用。但是,它们主要仅限于植物中的安萨巴家族。在这项研究中,发现3-OPC羧基甲基转移酶(OPCMT),它们具有与Sabath MTS不同的催化机制,并且在微生物中广泛分布,显着扩大了小分子CBMT的知识和可用性。这些甲基转移酶(MTS)对于新生儿菌是必不可少的,而在人类中未发现,这表明它们可以成为抗生素的理想靶标。此外,它们的笨重的底物结合口袋将它们与其他MT区分开,可以促进特定抑制剂的设计。最后,OPCMT的广泛底物特异性和高催化效率也为可持续生产甲基提供了有价值的工具。
b'sandwich排列,其中包含捕获目标 - 信号探针。随后通过监测被观察到的甲基蓝(MB)的峰值电流变化来检测到所得的DNA杂交事件,该脉冲伏安法(DPV)被用作氧化还原物种的峰值电流变化,并实现了35 AM的检测极限。 Wang等。 [5]开发了一种基于RGO和锰四苯基 - 苯基苯基苯基二磷酸结构的自组装纳米复合材料的DNA生物传感器,从而导致6 \ XC3 \ X9710 14 M.的检测极限。 [6]采用了由捕获DNA序列组成的转换界面,在玻璃碳电极上官能化RGO,以构造无标记的DNA生物传感器,并达到了4.28 \ XC3 \ X9710 19 M.的检测极限。 Chen等。 [7]还基于由氧化铜纳米线和羧基官能化的单壁碳纳米管(SWCNT)组成的杂化纳米复合材料(SWCNTS)开发了特定的序列DNA检测。 DNA检测是通过循环伏安法和3.5 \ xc3 \ x9710 15 m的检测极限。周等人。 [8]使用化学的RGO电极通过差分脉冲伏安法对ssDNA和dsDNA中的四个DNA碱基的无标记的电化学检测进行了无标记的电极。他们达到了2.0 \ XCE \ XBC M的检测极限,线性浓度范围为0.01至10 mm。在另一个
b'sandwich排列,其中包含捕获目标 - 信号探针。随后通过监测观察到的亚甲基蓝(MB)的峰值电流变化来检测所得的DNA杂交事件,该峰值电流变化被用作氧化还原物种,并实现了35 AM的检测极限。Wang等。 [5]基于RGO和锰四苯基孢子的A \ XCF \ X80-偶联结构的自组装纳米复合材料开发了DNA生物传感器,导致6 \ xc3 \ x9710 14M的检测极限,在另一项研究中,在另一项研究中,Ye等。 [6]采用了一个转导界面,该界面由捕获的DNA序列,Aunps和Thionines在玻璃碳电极上官能化RGO来构建无标记的DNA生物传感器,并获得了4.28 \ xc3 \ x9710 199的检测极限。 Chen等。 [7]还基于由氧化铜纳米线和羧基官能化的单壁碳纳米管(SWCNT)组成的杂化纳米复合材料(SWCNTS)开发了特定的序列DNA检测。 DNA检测是通过循环伏安法和3.5 \ xc3 \ x9710 15 m的检测极限。 Zhou等。 [8]使用化学上的RGO电极通过差分脉冲伏安法对ssDNA和dsDNA中的四个DNA碱基的无标记电化学检测进行了。 他们达到了2.0 \ XCE \ XBC M的检测极限,线性浓度范围为0.01至10 mm。 在另一项研究中,Zhang等人。 [9]为特定序列检测制造了无标记的DNA传感器。Wang等。[5]基于RGO和锰四苯基孢子的A \ XCF \ X80-偶联结构的自组装纳米复合材料开发了DNA生物传感器,导致6 \ xc3 \ x9710 14M的检测极限,在另一项研究中,在另一项研究中,Ye等。[6]采用了一个转导界面,该界面由捕获的DNA序列,Aunps和Thionines在玻璃碳电极上官能化RGO来构建无标记的DNA生物传感器,并获得了4.28 \ xc3 \ x9710 199的检测极限。Chen等。 [7]还基于由氧化铜纳米线和羧基官能化的单壁碳纳米管(SWCNT)组成的杂化纳米复合材料(SWCNTS)开发了特定的序列DNA检测。 DNA检测是通过循环伏安法和3.5 \ xc3 \ x9710 15 m的检测极限。 Zhou等。 [8]使用化学上的RGO电极通过差分脉冲伏安法对ssDNA和dsDNA中的四个DNA碱基的无标记电化学检测进行了。 他们达到了2.0 \ XCE \ XBC M的检测极限,线性浓度范围为0.01至10 mm。 在另一项研究中,Zhang等人。 [9]为特定序列检测制造了无标记的DNA传感器。Chen等。[7]还基于由氧化铜纳米线和羧基官能化的单壁碳纳米管(SWCNT)组成的杂化纳米复合材料(SWCNTS)开发了特定的序列DNA检测。DNA检测是通过循环伏安法和3.5 \ xc3 \ x9710 15 m的检测极限。Zhou等。 [8]使用化学上的RGO电极通过差分脉冲伏安法对ssDNA和dsDNA中的四个DNA碱基的无标记电化学检测进行了。 他们达到了2.0 \ XCE \ XBC M的检测极限,线性浓度范围为0.01至10 mm。 在另一项研究中,Zhang等人。 [9]为特定序列检测制造了无标记的DNA传感器。Zhou等。[8]使用化学上的RGO电极通过差分脉冲伏安法对ssDNA和dsDNA中的四个DNA碱基的无标记电化学检测进行了。他们达到了2.0 \ XCE \ XBC M的检测极限,线性浓度范围为0.01至10 mm。在另一项研究中,Zhang等人。 [9]为特定序列检测制造了无标记的DNA传感器。在另一项研究中,Zhang等人。[9]为特定序列检测制造了无标记的DNA传感器。将DNA固定在用石墨烯,Aunps和Polythionine(Pthion)修饰的玻璃碳电极上。通过不同的脉冲伏安法检测到杂交,并且在0.1 pm至10 nm的动态范围内达到了35 fm的检测极限。Bo等人开发了石墨烯和聚苯胺的电化学DNA生物传感器。[10]用于DPV检测辅助DNA序列,并达到了'








![b'sandwich排列,其中包含捕获目标 - 信号探针。随后通过监测被观察到的甲基蓝(MB)的峰值电流变化来检测到所得的DNA杂交事件,该脉冲伏安法(DPV)被用作氧化还原物种的峰值电流变化,并实现了35 AM的检测极限。 Wang等。 [5]开发了一种基于RGO和锰四苯基 - 苯基苯基苯基二磷酸结构的自组装纳米复合材料的DNA生物传感器,从而导致6 \ XC3 \ X9710 14 M.的检测极限。 [6]采用了由捕获DNA序列组成的转换界面,在玻璃碳电极上官能化RGO,以构造无标记的DNA生物传感器,并达到了4.28 \ XC3 \ X9710 19 M.的检测极限。 Chen等。 [7]还基于由氧化铜纳米线和羧基官能化的单壁碳纳米管(SWCNT)组成的杂化纳米复合材料(SWCNTS)开发了特定的序列DNA检测。 DNA检测是通过循环伏安法和3.5 \ xc3 \ x9710 15 m的检测极限。周等人。 [8]使用化学的RGO电极通过差分脉冲伏安法对ssDNA和dsDNA中的四个DNA碱基的无标记的电化学检测进行了无标记的电极。他们达到了2.0 \ XCE \ XBC M的检测极限,线性浓度范围为0.01至10 mm。在另一个](/simg/9/95e0d0afb2a6a7d5d7547557c83da02f0068910b.webp)
