XiaoMi-AI文件搜索系统
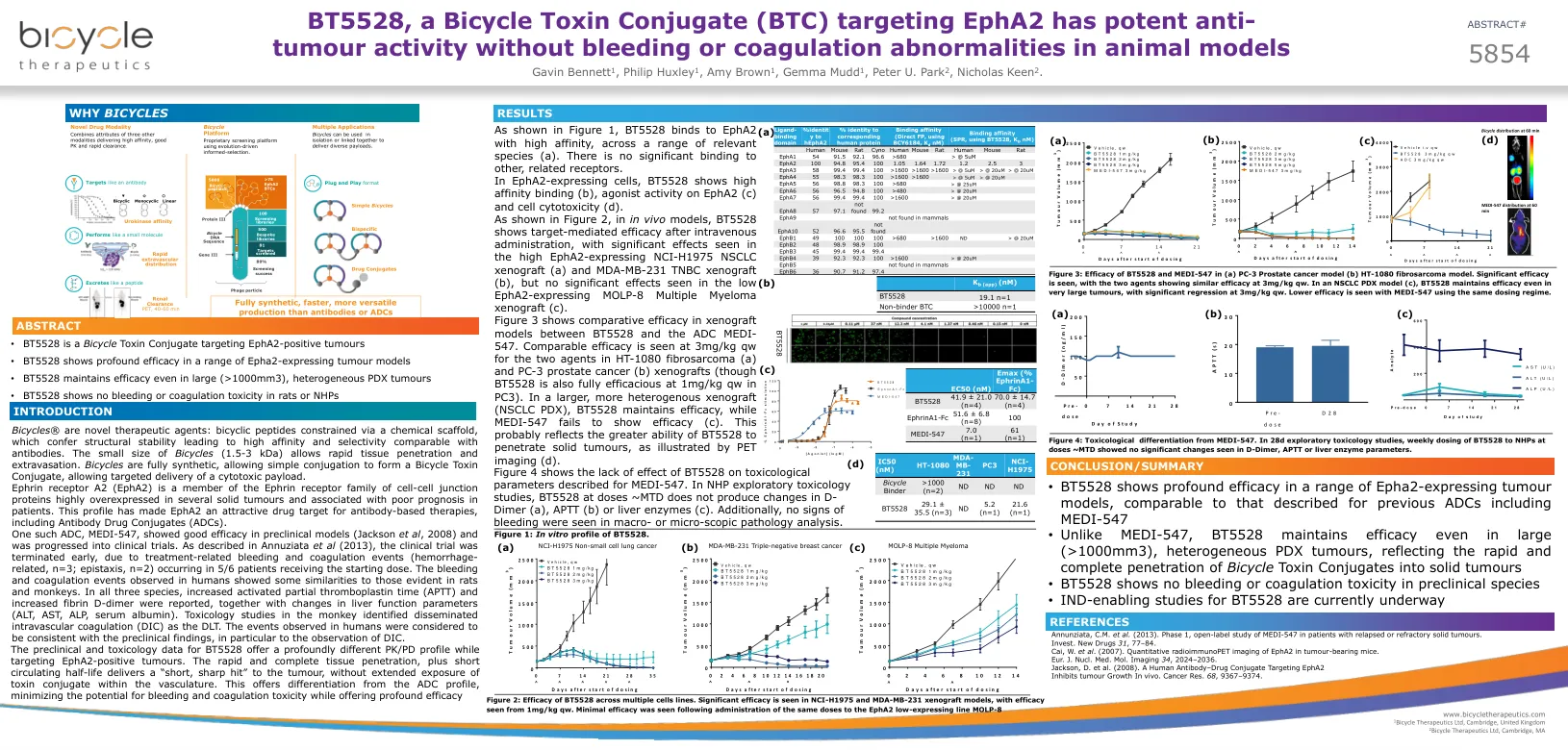
World File Search SystemBT5528 是一种针对 EphA2 的自行车毒素结合物 (BTC),在动物模型中具有强大的抗肿瘤活性,且不会引起出血或凝血异常
Bicycles® 是新型治疗剂:通过化学支架约束的双环肽具有结构稳定性,因此具有与抗体相当的高亲和力和选择性。Bicycles 体积小(1.5-3 kDa),可以快速渗透和渗出组织。Bicycles 是完全合成的,可以通过简单结合形成双环毒素结合物,从而实现细胞毒性有效载荷的靶向递送。Ephrin 受体 A2 (EphA2) 是 Ephrin 受体家族细胞间连接蛋白的成员,在多种实体瘤中高度过表达,与患者预后不良有关。这一特性使 EphA2 成为抗体疗法(包括抗体药物结合物 (ADC))的一个有吸引力的药物靶点。一种这样的 ADC,MEDI-547,在临床前模型(Jackson 等人,2008 年)中表现出良好的疗效,并已进入临床试验阶段。如 Annuziata 等人 (2013) 所述,临床试验提前终止,因为在接受起始剂量的 6 名患者中 5 名发生了治疗相关的出血和凝血事件(出血相关,n=3;鼻出血,n=2)。在人类中观察到的出血和凝血事件与大鼠和猴子中出现的事件有一些相似之处。在这三个物种中,都报告了活化部分凝血活酶时间 (APTT) 增加和纤维蛋白 D-二聚体增加,同时肝功能参数(ALT、AST、ALP、血清白蛋白)发生变化。对猴子的毒理学研究发现弥漫性血管内凝血 (DIC) 是 DLT。在人类中观察到的事件被认为与临床前发现一致,尤其是 DIC 的观察结果。
多级力依赖性变构增强Ae-
经典的钙粘蛋白是跨膜蛋白,其细胞外域连接相邻细胞,其细胞内结构域通过B-蛋白酶和A -Catenin连接到肌动蛋白细胞骨架。cadherin- catenin络合物传递了驱动组织形态发生和伤口愈合的力。此外,E-catenin构象的张力依赖性变化使其能够募集肌动蛋白结合蛋白葡萄蛋白到细胞 - 细胞连接蛋白,从而有助于连接性增强。多种钙粘蛋白复合物的方式以及是否合作以加强对负载的细胞 - 细胞连接的构成。在这里,我们使用了单分子光学陷阱测量值来检查多种钙粘蛋白 - catenin络合物如何在负载下与F-肌动蛋白相互作用,以及这种相互作用如何受到杂质蛋白的影响。我们表明,朝向肌动灯的()末端的力导致平均寿命长3倍,比将力施加到刺(+)末端时。我们还通过包含钙粘蛋白 - 钙蛋白复合物和葡萄蛋白头部区域的第四纪复合物测量了依赖性的肌动蛋白结合,它们本身无法结合肌动蛋白。该四元复合物的结合寿命随着额外的配合物结合的F-肌动蛋白而增加,但仅当载荷朝向()末端定向时。相比之下,单独的钙粘蛋白 - 钙蛋白复合物并未显示这种合作的形式。2023 Elsevier Ltd.保留所有权利。这些发现揭示了多级,力依赖性调节,从而增强了多个钙粘蛋白/catenin络合物与F-肌动蛋白的缔合的强度,从而提供了阳性反馈,从而可以增强结并促进F-肌动蛋白,从而促进高阶细胞骨架组织的出现。
鸟类中富含 GC 的 LAT 基因的鉴定
T 细胞激活连接蛋白 (LAT) 是 T 细胞抗原受体 (TCR) 信号通路中一个关键的跨膜衔接蛋白 [1-4]。它由一个非常短的胞外结构域、一个具有两个棕榈酰化半胱氨酸残基的跨膜结构域和一个含有多个信号磷酸酪氨酸基序的胞内尾部组成 [1、2、5、6]。LAT 的重要性首次在 LAT 缺陷的 Jurkat 细胞系 JCaM2 和 ANJ3 中得到证实。这些细胞系在 TCR 激活后,钙信号传导和 ERK 磷酸化受损 [2、7]。LAT 缺陷的小鼠在早期胸腺 T 细胞发育中表现出严重的阻碍,导致外周 T 细胞数量低 [4、8、9] 和远端 TCR 信号传导缺陷 [2、4、10]。 LAT 胞内部分有 9 个保守的酪氨酸残基 (Y132、Y171、Y191 和 Y226,本文按照人类 LAT 编号),其中 4 个被鉴定为 TCR 信号级联中几个下游分子的重要停泊位点,如 Grb2、Gad 和 PLCγ1[1-3、6、10-13]。这些酪氨酸残基通过 ZAP-70 激酶进行磷酸化,是触发下游信号通路的关键步骤[1、2、13]。磷酸化的 Y132 是 LAT 中唯一能募集 PLCγ1 的基序。因此,Y132 对 Jurkat 细胞和小鼠的 TCR 下游信号转导至关重要[2、9、11-14]。令人惊讶的是,由于四足动物中所有已知的 LAT 序列中 131 位都有甘氨酸残基,Y132 不是 ZAP-70 的最佳底物 [ 12 , 15 ]。有人提出,低效的
免疫检查点抑制剂诱导的免疫介导的肝炎:当前的更新和未来观点
上皮可塑性,上皮细胞改变表型的能力,是一种令人着迷的现象,已被广泛研究了数十年。最常见的上皮可塑性是指上皮和间质表型之间的转化,称为上皮to-to-Emespoodymal Transition(EMT)和间质向上皮到上皮过渡(MET)。EMT和MET都是胚胎发育,组织对损伤的反应,例如炎症,修复和癌症的常见特征。收集了一系列原始研究文章和研究报告,以解决人类和其他模型系统中上皮可塑性,其区分和功能的迷人和复杂状态。上皮到间充质转变(EMT)已经过经典定义为一种发育程序,它在许多器官的早期胚胎图案中发挥了作用,其特征是上皮细胞失去细胞对细胞粘附,上皮紧密连接点和向脉炎。进化上,EMT过程使生物可以通过从原始外胚层产生中胚层的间充质细胞来获取更多复杂的结构。EMT是组织和器官的生理修复和病理纤维化的基本过程。最近,人们已经认识到,EMT在促进促肿瘤微环境的创造方面也起着至关重要的作用,从而促进肿瘤发生和转移。细胞间连接(尤其是紧密连接)的重组是肿瘤进展过程中EMT过程的关键事件。在本期内Neyrinck-Leglantier等。发表了他们的研究工作,调查了紧密的连接蛋白齐路coccludens-1(ZO-1)如何参与调节肿瘤微环境。使用体外和体内模型都证明,将膜相关的ZO-1迁移到细胞核区室可以调节促炎性趋上趋化因子的分泌,因此
骨细胞筛选平台中的 3D 树突状网络......
摘要 与年龄相关的肌肉骨骼疾病(包括骨质疏松症)很常见且与长期发病有关,进而严重影响医疗保健系统的可持续性。因此,迫切需要开发可靠的疾病和药物筛选临床前模型,以便以个性化的方式验证新药,而无需进行体内检测。在骨组织中,虽然骨细胞 (Oc) 网络是一个公认的治疗靶点,但目前的体外临床前模型无法模拟其生理相关且高度复杂的结构。为此,需要多种特征,包括拟骨细胞外基质、动态灌注和机械提示(例如剪切应力)以及 Oc 的三维 (3D) 培养。我们在此首次描述了一种基于 96 个微型芯片的高通量微流控平台,用于大规模临床前评估以预测药物功效。我们通过开发和注射一种高硬度的类骨 3D 基质,对一种可实时可视化并配备多芯片的商业微流体装置进行了生物工程改造,这种基质由富含胶原蛋白的天然水凝胶与羟基磷灰石纳米晶体的混合物制成。微通道中充满了拟骨基质和 Oc,受到被动灌注和剪切应力。我们使用扫描电子显微镜对材料进行初步表征。将材料注入微通道后,使用共聚焦显微镜和荧光微珠检测体积变化和水凝胶内细胞大小物体的分布。通过测量细胞活力、评估表型标志物(连接蛋白 43、整合素 α V/CD51、硬化蛋白)、树突量化和对合成代谢药物的反应性来监测 Oc 的 3D 树突网络的形成。该平台有望加速旨在调节骨细胞生存和功能的新药开发。
吞吐技术研究宿主 - 病原体相互作用
几年,人们对在实验中过度使用动物的使用越来越多,尤其是出于道德原因,这导致了搜索可靠的替代模型,例如体外,ex vivo,以及可以在科学研究中使用的硅方法,可作为动物模型替代或替代动物模型的辅助方法(4)。真核细胞培养是许多生物医学应用的动物模型的有趣替代方法,但是这些方法受到限制,因为它们通常涉及单层中的细胞系,但未能模仿重要的组织功能。为了改善这些模型,可以在三维培养物(3D)中生长细胞系,从而发展一些典型的组织结构,例如在肠道细胞的情况下,紧密连接蛋白的表达和粘蛋白的产生(3,5,6)。此外,如表1所述,可以在3D培养物中种植不同类型的细胞系,但是必须考虑它们的优点和缺点,以便为每个应用程序提供最佳的模型选择。三维细胞培养已应用于发育,细胞和癌症生物学以及宿主 - 细菌相互作用的研究,因为它模拟了体内发生的重要特征,包括在体外系统中的细胞细胞和细胞外基质相互作用(6,10,11)。这样的3D培养物代表了单一培养实验和用于研究传染病的动物模型之间的中间立场,尤其是与高通量技术结合使用。鉴于高通量技术的可及性和可负担性的增加(例如,)鉴于高通量技术的可及性和可负担性的增加(例如,这种组合有助于确定宿主特异性免疫反应和病原体相互作用,从而导致对感染的发病机理和治疗的新见解(12-14)。转录组学,蛋白质组学和代谢组学)有很大的机会来测量模型系统中3D培养物的响应,无论是在真核组织侧还是在细菌相互作用的侧面
对于JHRR的贡献,请通过电子邮件联系:editor@jhrlmc.com,基于虚拟现实的康复计划的原始文章有效性与
摘要。精子干细胞(SSC)具有重新殖民的独特能力,可以重新定殖。在微注射中,将精神小管的腹腔隔室通过血液测试屏屏障(BTB)转移到小管的基础室,并重新启动精子发生。最近发现,WIN18,446抑制视黄酸信号传导通过瞬时抑制精子分化,从而增强了SSC定植,从而促进了生育能力的恢复。在这项研究中,我们报告说Win18,446通过破坏BTB来增加SSC定殖。Win18,446改变了紧密连接蛋白(TJP)的表达模式,并破坏了Busulfan处理的小鼠中的BTB。Win18,446上调了FGF2的表达,FGF2是SSC的自我更新因素之一。虽然Win18,446在Busulfan治疗的野生型小鼠中增强了SSC殖民化,但它并没有增加缺乏BTB的Busulfan治疗的CLDN11缺乏小鼠的定殖水平,这表明缺乏BTB,这表明在野生型睾丸中增强了BTB的损失。串行移植分析显示,Win18,446引起的自我更新受损,表明Win18,446介导的视黄酸信号传导抑制了SSC自我更新。引人注目的是,Win18,446政府导致45%的Busulfan处理的受体小鼠死亡。这些发现表明,TJP调制是Win18,446增强SSC归宿的主要机制,并引起了人们对使用Win18,446进行人类SSC移植的担忧。关键词:血睾丸屏障,归巢,精子,Win18,446
可溶性环氧水解酶抑制剂TPPU减轻NAB- ...
目标。紫杉醇诱导的周围神经病(PIPN)是紫杉醇的令人衰弱的,很难进行治疗的侧面。可溶性环氧化物水解酶(SEH)可以迅速将内源性抗炎介质的环氧化脱烯酸(EET)代谢为二羟基二酸酯。TIS研究旨在评估SEH抑制剂N-(1-(1-氧化)-4-磷酸胺] -n' - (三氟甲氧基)苯基)-UREA(TPPU)在大鼠PIPN中起关键作用,并为治疗提供了新的治疗目标。方法。建立了由NAB-列甲赛诱导的PIPN的Sprague-Dawley雄性大鼠模型。大鼠随机分为对照组,NAB-列甲赛组和Nab-Paclitaxel + TPPU(SEH抑制剂)组,每个组中有36只大鼠。检测到SEH抑制剂TPPU对行为测定,凋亡,神经胶质激活,轴突损伤,微结构以及血脊髓屏障的渗透性,并通过检查NF-κB信号通道的表达来探索基本机制。结果。Te results showed that the mechanical and thermal pain thresholds of rats were decreased after nab-paclitaxel treatment, accompanied by an increased expression of axonal injury-related proteins, enhanced cell apoptosis, aggravated destruction of vascular permeability, intense glial responses, and elevated in- fammatory cytokines and oxidative stress in the L4-L6 spinal cord.tppu通过抑制SEH和NF-κB信号通路的激活,通过降低杀菌性细胞因子的水平和氧化应激来解释PIPN。结论。TPPU通过增加紧密连接蛋白的表达来恢复机械和热阈值,减少细胞凋亡,减少轴突损伤和神经胶质反应以及保护血管通透性。tese fndings支持SEH在PIPN中的作用,并表明SEH的抑制代表了PIPN的潜在新治疗靶标。
研究文章通过调节微生物群 - 脑轴
微生物群 - 脑轴的抽象干扰可能有助于阿尔茨海默氏病的发展。镁l-硫盐最近被发现对老年和阿尔茨海默氏病模型小鼠的学习和记忆具有保护作用。然而,镁l-硫酸镁对阿尔茨海默氏病肠道菌群的影响尚不清楚。以前,我们报道说,镁l-硫代酯治疗改善了阿尔茨海默氏病模型小鼠的双转基因系中的氧化应激和炎症减少,表达淀粉样蛋白-β前体蛋白质和突变体人类presenilin Presenilin 1(App/ps1)。在这里,我们在类似的小鼠模型中进行了16S rRNA扩增子测序和液相色谱质量光谱法,以分析镁l-三 - 苏酸盐暴露后的微生物组和血清代谢组的变化。镁l-硫代盐调节了肠道菌群中三个属的丰度,减少了同种球菌,并增加了双歧杆菌和曲霉杆菌。我们还发现,镁 - 硫酸镁调节的血清中的差分代谢产物富含与神经退行性疾病相关的各种途径。在肠道紧密连接蛋白上的蛋白质印迹检测(Zona occludens 1,occludin和claudin-5)表明镁l-硫代苯甲酸镁修复了APP/PS1小鼠的肠屏障功能障碍。这些发现表明,镁l-硫酸镁可以通过模型小鼠中的微生物群 - 脑轴降低阿尔茨海默氏病的临床表现,从而为阿尔茨海默氏病的临床治疗提供了实验基础。关键词:阿尔茨海默氏病; APP/PS1双转基因阿尔茨海默氏病小鼠模型;炎;肠屏障功能障碍;镁l-硫酸镁;微生物组;微生物群 - 脑轴;氧化应激;血清代谢物
光遗传学激活星形胶质细胞可降低血液
摘要:光遗传学已被用于调节星形胶质细胞活性并调节脑损伤后的神经元功能。活化的星形胶质细胞调节血脑屏障功能,从而参与脑修复。然而,光遗传学激活的星形胶质细胞对缺血性中风屏障功能变化的影响和分子机制仍不清楚。在本研究中,成年雄性 GFAP-ChR2-EYFP 转基因 Sprague-Dawley 大鼠在光血栓性中风后 24、36、48 和 60 小时接受光遗传学刺激以激活同侧皮质星形胶质细胞。使用免疫染色、蛋白质印迹、RT-qPCR 和 shRNA 干扰探索活化的星形胶质细胞对屏障完整性的影响及其潜在机制。进行神经行为测试以评估治疗效果。结果表明,光遗传学激活星形胶质细胞后,IgG 漏出、紧密连接蛋白间隙形成和基质金属肽酶 2 表达均减少( p <0.05)。此外,与对照组相比,光刺激星形胶质细胞可保护中风大鼠的神经元免于凋亡并改善神经行为结果( p <0.05)。值得注意的是,大鼠缺血性中风后光遗传学激活的星形胶质细胞中白细胞介素 10 的表达显著增加。抑制星形胶质细胞中的白细胞介素 10 会削弱光遗传学激活的星形胶质细胞的保护作用( p <0.05)。我们首次发现来自光遗传学激活的星形胶质细胞的白细胞介素 10 通过降低基质金属肽酶 2 的活性和减弱神经元凋亡来保护血脑屏障的完整性,这为缺血性中风急性期提供了一种新的治疗方法和靶点。关键词:星形胶质细胞、血脑屏障、白细胞介素 10、光遗传学、中风 引言 星形胶质细胞可以被动支持神经元的发育和存活,或主动调节突触传递和血脑屏障 (BBB) 的完整性 [1]。星形胶质细胞活化是缺血性中风的一个重要特征。活化的星形胶质细胞通过释放炎症因子(如 IL-6、TNF-α、IL-1α、IL-1β、干扰素 γ (IFNγ) 和自由基)发挥有害作用 [2]。它还可以通过释放