XiaoMi-AI文件搜索系统
World File Search System目的构建的逆转录酶和TAQ DNA聚合酶在存在抑制剂的情况下可提供高产量
分子诊断(MDX)应用的许多进步是建立在新型酶的工程上的,这些酶允许访问以前无法捕获的信息。为了满足对高度功能和专用的酶促工具的不断发展的需求,我们利用了酶工程平台的组合,包括专有平台,该平台使我们能够选择具有基因组学和分子诊断应用的功能。我们的平台可以使多种DNA和RNA修改的酶进行工程,这些酶利用大规模的,无假设的文库作为选择输入,以增强酶活性和/或引入新型活动。我们介绍了有关逆转录酶(RT)和TAQ DNA聚合酶(TAQ DNAP)的工程工作的数据 - 两种通常用于检测患者样品中的RNA和/或DNA病毒的酶以进行护理点(POC)诊断。我们的屏幕确定了RT变体,具有增加的热稳定性和对抑制剂和TAQ DNAP变体的耐受性,对抑制剂的速度和耐受性提高。
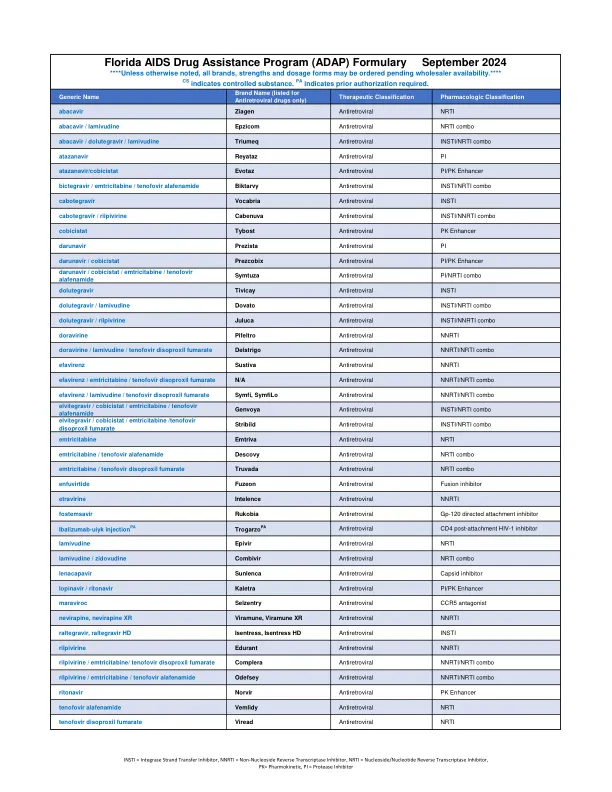
佛罗里达艾滋病药物援助计划(ADAP)格式2024年9月
insti =整合酶链转移抑制剂,NNRTI =非核苷逆转录酶抑制剂,NRTI =核苷/核苷酸逆转录酶抑制剂,
高通量变体库和机器学习为 Retron 基因编辑器提供设计规则
细菌逆转录酶系统在许多生物技术应用中充当单链 DNA 的细胞内工厂。在这些技术中,天然的逆转录酶非编码 RNA (ncRNA) 被修饰以编码模板,以通过逆转录产生定制 DNA 序列。逆转录效率是逆转录酶技术的主要限制步骤,但我们缺乏系统的知识,了解如何在改变逆转录酶序列以产生定制 DNA 的同时提高或保持逆转录效率。在这里,我们测试了数千种对逆转录酶-Eco1 ncRNA 的不同修饰,并在汇集变体文库实验中测量 DNA 的产生,从而确定了 ncRNA 中对修饰具有耐受性和不耐受性的区域。我们将这些新信息应用于特定应用:使用逆转录酶与 CRISPR-Cas9 RNA 引导核酸酶 (editron) 结合产生精确的基因组编辑供体。我们使用酿酒酵母中的高通量文库来额外定义编辑酶的设计规则。我们将有关 retron DNA 生成和编辑子设计规则的新知识扩展到人类基因组编辑,以实现迄今为止最高效率的 retron-Eco1 编辑子。
勘误
r 1,r 2或r 4表示每天利托那韦胶囊的数量。*仅适用于经验丰富的患者。W不是首选方案,而是承认节省的潜在成本。Z Trizivir S D 635。ABC,Abacavir;阿特扎那韦的阿兹; IDV,indinavir; EFV,efavirenz; FOS,Fosamprenavir; LPV,Lopinavir; nfv,nel finavir; NRTI,核苷逆转录酶抑制剂; NNRTI,非核苷逆转录酶Inhibitor; NVP,奈韦拉平; PL,蛋白酶抑制剂; R,Ritonavir; SQV,Saquinavir; TPV,Tipranavir; t2o,enfuvirtide。ABC,Abacavir;阿特扎那韦的阿兹; IDV,indinavir; EFV,efavirenz; FOS,Fosamprenavir; LPV,Lopinavir; nfv,nel finavir; NRTI,核苷逆转录酶抑制剂; NNRTI,非核苷逆转录酶Inhibitor; NVP,奈韦拉平; PL,蛋白酶抑制剂; R,Ritonavir; SQV,Saquinavir; TPV,Tipranavir; t2o,enfuvirtide。
甲状腺癌中的端粒酶逆转录酶启动子突变:精确肿瘤学的含义 - 叙事评论
v600e),或RAS突变或RET -PTC融合,而大多数FTC具有PAX8 -PPARγ融合或RAS突变,但很少表现出改变的BRAF。同时,BRAF和RAS突变都经常出现在PDTC和ATC中,并且抑制肿瘤抑制剂TP53的失活很常见,尤其是在ATC中(7,9,10)。此外,在大约三分之一和十分之一的ATC中看到了其他肿瘤抑制剂(包括CDKN2A-RB1和PTEN)的畸变(7,9)。与分化的FTC或PTC相比,肿瘤抑制器的失活显然是未分化的PDTC和ATC的定义特征。总体而言,上面的基因组和表观遗传改变以及对患者特定临床特征的认识的越来越多,使TC护理中的精确药物成为疾病诊断,风险分层,预后和治疗决策或靶向治疗药物的实现范式。
FDA艾滋病毒药物的批准
药物类缩写:AI:附着抑制剂; CA:CCR5拮抗剂; CI:衣壳抑制剂; FDC:固定剂量组合; FI:融合抑制剂; Insti:集成酶抑制剂; NNRTI:非核苷逆转录酶抑制剂; NRTI:核苷逆转录酶抑制剂; PE:药代动力学增强剂; P I蛋白酶抑制剂; PAI:辅助后抑制剂;准备:暴露前预防
OTS - 基因编辑专利.docx
Prime 编辑通过使用向导 RNA 将 Prime 编辑复合物引导至 DNA 内的特定位置来实现这一点。该复合物含有一种经过修饰的 Cas9 蛋白,称为“Prime 编辑器”,与逆转录酶融合 (2)。Prime 编辑器旨在识别特定的 DNA 序列并切割双螺旋的一条链,从而使逆转录酶能够使用未切割的链作为模板,在切割位点添加或删除特定核苷酸。
端粒酶逆转录酶基因在胶质母细胞瘤中的生物学和临床作用:潜在的治疗靶点?
1神经系统医学肿瘤科,博洛尼亚神经科学研究所,意大利博洛尼亚40139; enricofra@yahoo.it(E.F.)2实验,诊断和专业医学系,博洛尼亚大学,40138博洛尼亚,意大利博洛尼亚3号肿瘤学系,BOOLOGNA,40139 BOOLOGNA,40139意大利,意大利4个固体分子病理学实验室,IRCCS-OSPEDALIENICE 5 BOOGNAICE ITALICY ITALICY ITALICY ITALICY ITALICY ITALICY ITALICANICE ITALICANICALICANICANICALIONICERION,40138博洛尼亚大学,波洛尼亚大学40126年,意大利博洛尼亚大学6 IRCCS神经科学研究所,博洛尼亚,40139博洛尼亚,意大利7号生物医学和神经运动科学系(DIBINEM),手术病理病理学分离,Boologna * Boologna,BBOLOGION * stefania.bartolini@isnb.it;电话。: +39-051-6225-697†联合第一位作者 - 这些作者对这项工作也同样贡献。
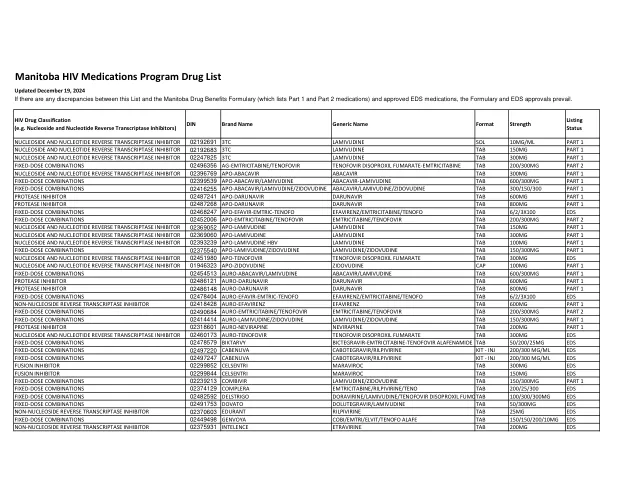
马尼托巴 HIV 药物计划药物清单
核苷和核苷酸逆转录酶抑制剂 02192691 3TC 拉米夫定溶液 10MG/ML 第 1 部分 核苷和核苷酸逆转录酶抑制剂 02192683 3TC 拉米夫定片 150MG 第 1 部分 核苷和核苷酸逆转录酶抑制剂 02247825 3TC 拉米夫定片 300MG 第 1 部分 固定剂量组合 02496356 AG-恩曲他滨/替诺福韦 替诺福韦二吡呋酯富马酸盐-恩曲他滨片 200/300MG 第 2 部分 核苷和核苷酸逆转录酶抑制剂转录酶抑制剂 02396769 APO-阿巴卡韦 阿巴卡韦 TAB 300MG 第 1 部分 固定剂量组合 02399539 APO-阿巴卡韦/拉米夫定 阿巴卡韦-拉米夫定 TAB 600/300MG 第 1 部分 固定剂量组合 02416255 APO-阿巴卡韦/拉米夫定/齐多夫定 阿巴卡韦/拉米夫定/齐多夫定 TAB 300/150/300 第 1 部分 蛋白酶抑制剂 02487241 APO-达芦那韦 达芦那韦 TAB 600MG 第 1 部分 蛋白酶抑制剂 02487268 APO-达芦那韦 达芦那韦 TAB 800MG 第 1 部分 固定剂量组合 02468247 APO-依法韦-恩曲他滨-替诺福 依法韦仑/恩曲他滨/替诺福韦片 6/2/3X100 EDS 固定剂量组合 02452006 APO-恩曲他滨/替诺福韦 恩曲他滨/替诺福韦片 200/300MG 第 2 部分 核苷和核苷酸逆转录酶抑制剂 02369052 APO-拉米夫定 拉米夫定片 150MG 第 1 部分 核苷和核苷酸逆转录酶抑制剂 02369060 APO-拉米夫定 拉米夫定片 300MG 部分1 核苷和核苷酸逆转录酶抑制剂 02393239 APO-拉米夫定 HBV 拉米夫定片 100 毫克 第 1 部分 固定剂量组合 02375540 APO-拉米夫定/齐多夫定 拉米夫定/齐多夫定片 150/300 毫克 第 1 部分 核苷和核苷酸逆转录酶抑制剂 02451980 APO-替诺福韦 替诺福韦二吡呋酯富马酸盐片 300 毫克 EDS 核苷和核苷酸逆转录酶抑制剂 01946323 APO-齐多夫定 齐多夫定胶囊 100 毫克 第 1 部分固定剂量组合 02454513 AURO-阿巴卡韦/拉米夫定 阿巴卡韦/拉米夫定片 600/300MG 第 1 部分 蛋白酶抑制剂 02486121 AURO-达芦那韦 达芦那韦片 600MG 第 1 部分 蛋白酶抑制剂 02486148 AURO-达芦那韦 达芦那韦片 800MG 第 1 部分 固定剂量组合 02478404 AURO-依法韦韦-恩曲他滨-替诺福 依法韦仑/恩曲他滨/替诺福片 6/2/3X100 EDS 非核苷逆转录酶抑制剂 02418428 AURO-依法韦仑依非韦伦片 600MG 第 1 部分 固定剂量组合 02490684 金-恩曲他滨/替诺福韦 恩曲他滨/替诺福韦片 200/300MG 第 2 部分 固定剂量组合 02414414 金-拉米夫定/齐多夫定 拉米夫定/齐多夫定片 150/300MG 第 1 部分 蛋白酶抑制剂 02318601 金-奈韦拉平 奈韦拉平片 200MG 第 1 部分 核苷和核苷酸逆转录酶抑制剂 02460173 金-替诺福韦 替诺福韦二吡呋酯富马酸盐片 300MG EDS固定剂量组合 02478579 BIKTARVY BICTEGRAVIR-恩曲他滨-替诺福韦艾拉芬胺片 50/200/25MG EDS 固定剂量组合 02497220 CABENUVA 卡博替拉韦/利匹韦林套装 - 注射 200/300 MG/ML EDS 固定剂量组合 02497247 CABENUVA 卡博替拉韦/利匹韦林套装 - 注射 200/300 MG/ML EDS 融合抑制剂 02299852 CELSENTRI MARAVIROC 片 300MG EDS 融合抑制剂 02299844 CELSENTRI MARAVIROC TAB 150MG EDS 固定剂量组合 02239213 COMBIVIR 拉米夫定/齐多夫定 TAB 150/300MG 第 1 部分 固定剂量组合 02374129 COMPLERA 恩曲他滨/利匹韦林/TENO TAB 200/25/300 EDS 固定剂量组合 02482592 DELSTRIGO 多拉维林/拉米夫定/替诺福韦二吡呋酯 FUMOTAB 100/300/300MG EDS 固定剂量组合 02491753 DOVATO 多鲁替拉维/拉米夫定 TAB 50/300MG EDS非核苷逆转录酶抑制剂 02370603 EDURANT 利匹韦林 TAB 25MG EDS 固定剂量组合 02449498 GENVOYA COBI/EMTRI/ELVIT/TENOFO ALAFE TAB 150/150/200/10MG EDS 非核苷逆转录酶抑制剂 02375931 INTELENCE 依曲韦林 TAB 200MG EDS