XiaoMi-AI文件搜索系统
World File Search System探索肠道通透性
近年来,肠道渗透性已成为肠道健康的主要特征。本文的观点是介绍基于文献对当前对睾丸渗透性的理解的概述。肠道通透性的概念从发现紧密连接的发现开始了其发展 - 上皮细胞之间分离的蛋白质复合物。组织病理学是微观诊断的主要选择,它允许确定紧密连接,炎症和上皮细胞受损的变化。此外,建议将肠道脂肪酸结合蛋白I-FABP和Zonulin作为上皮屏障的生物标志物。至于视觉检测,文献提出了胶囊内窥镜检查和共聚焦激光镜检查。使用后者可以产生小肠形态的图像,并可以看到小肠道腔,细胞,绒毛和隐窝。然而,数字胶囊内窥镜检查中的前进更适用,并有助于研究肠碳纤维和肠病,也可以在治疗方面带来有希望的结果。尽管对肠道通透性的损害可以归类为某种肠病,然后已经建立了某些肠道途径与铁缺乏症的关联,但铁缺乏症和肠道通透性的直接关联尚未探索。关键字:肠道,内窥镜检查,肠病毒,肠病,缺铁性贫血。
通过机器学习算法预测化合物的血脑屏障通透性
在针对中枢神经系统 (CNS) 的药物开发中,发现能够穿过血脑屏障 (BBB) 进入大脑的化合物是最具挑战性的评估。几乎 98% 的小分子无法渗透 BBB,从而影响药物在 CNS 中的吸收、分布、代谢和排泄 (ADME) 机制,从而降低药物在 CNS 中的药代动力学。由于 CNS 通常无法进行许多复杂的程序,并且对数千种化合物进行体外渗透性研究可能非常费力,因此尝试通过实施机器学习 (ML) 方法来预测化合物通过 BBB 的渗透性。在这项工作中,使用 KNIME Analytics 平台,开发了 4 个预测模型,其中有 4 种 ML 算法,然后采用十倍交叉验证方法来预测外部验证集。在 4 种 ML 算法中,极端梯度提升 (XGBoost) 在 BBB 渗透性预测中表现出色,并被选为部署的预测模型。数据预处理和特征选择增强了模型的预测能力,整体来看,模型在训练集和外部验证集上分别达到了86.7%和88.5%的准确率以及0.843和0.927的AUC,证明了该模型具有较高的预测稳定性。
评估二价化学物的细胞通透性......
摘要:二价化学降解剂提供了一种选择性降解疾病相关蛋白的催化途径。通过将靶标特异性配体与 E3 泛素连接酶募集配体连接,这些化合物可促进靶标蛋白的泛素化和蛋白酶体降解。由于这种多步骤机制的复杂性,有效降解分子的开发仍然是一个困难、漫长且不可预测的过程。由于降解剂是大型异双功能分子,这些化合物的效率可能受到较差的细胞通透性限制,目前还缺乏一种有效可靠的方法来量化这些化合物的细胞通透性。本文中,我们证明通过在 BRD4 特异性降解剂 MZ1 上添加氯烷标签,可以通过氯烷渗透试验来量化细胞通透性。通过将此分析扩展到降解剂分子的各个成分,我们获得了结构 - 渗透性关系,这将为未来降解剂的开发提供参考,特别是当降解剂作为潜在治疗方法进入临床时。
石墨烯的新离子通透性可以改变水过滤和传感器
首次由FrankWürthner领导的团队现在创建了一个具有缺陷的模型系统,该系统使Halides氟化物,氯化物和溴化物可以通过,但不是碘化物。这是在稳定的双层层中实现的,该双层由两个包围空腔的纳米仪组成。穿透的卤化离子在此腔中结合,以便可以测量进入所需的时间。
MCU抑制剂RU265的一个含二茂密的类似物,细胞通透性增加
化学与化学生物学区域,康奈尔大学,伊萨卡,纽约14853,美国。 摘要线粒体钙Uniporter(MCU)是一种跨膜蛋白,可介导线粒体钙(M Ca 2+)摄取。 MCU的抑制剂对于它们的应用是研究M Ca 2+摄取在细胞功能上的作用的工具。 在这项研究中,我们报告了两个有效的MCU抑制剂,[RU 2(μ-N)(NH 3)8(FCCO 2)2](OTF)3(RUOFC,FC = Ferrecene,OTF = Triflate)和[RU 2(μ-N)(μ-N)(μ-N)(μ-n)(nh 3)(nh 3)8(phco 2)8(phco 2)2](phco 2](oobz)3(OOBZ)3(robz)。 这些化合物是先前报道的抑制剂[RU 2(μ-N)(NH 3)8(Cl)2](Cl)3(RU265)的类似物,分别用铁甲基辅助辅助酯和苯甲酸酯和苯甲酸酯配体衍生。 两种化合物均通过NMR光谱,红外光谱和X射线晶体学合成并充分表征。 在生理条件下,Ruofc和Ruobz Aquate的半衰期分别为2.9和6.5 h,以产生[RU 2(μ-N)(NH 3)8(H 2 O)2](OTF)5(RU265ʹ)和游离羧酸盐。 在N,Nʹ-二甲基甲酰胺(DMF)中RUOFC的环状伏安法揭示了在0.64 V VS SCE处的突出的可逆2E转移事件,对应于两种二甲苯基轴向轴向配体的同时氧化。 所有三个复合物还表现出不可逆的RU基于RU的减少,在–1 V Vs SCE的电位下。 RU265',RUOFC和RUOBZ的DFT计算确认RUOFC的氧化还原活性是由二革新配体引起的。 此外,这三种化合物的Lumo能量与它们不可逆的还原电位相关。 17,18化学与化学生物学区域,康奈尔大学,伊萨卡,纽约14853,美国。摘要线粒体钙Uniporter(MCU)是一种跨膜蛋白,可介导线粒体钙(M Ca 2+)摄取。MCU的抑制剂对于它们的应用是研究M Ca 2+摄取在细胞功能上的作用的工具。 在这项研究中,我们报告了两个有效的MCU抑制剂,[RU 2(μ-N)(NH 3)8(FCCO 2)2](OTF)3(RUOFC,FC = Ferrecene,OTF = Triflate)和[RU 2(μ-N)(μ-N)(μ-N)(μ-n)(nh 3)(nh 3)8(phco 2)8(phco 2)2](phco 2](oobz)3(OOBZ)3(robz)。 这些化合物是先前报道的抑制剂[RU 2(μ-N)(NH 3)8(Cl)2](Cl)3(RU265)的类似物,分别用铁甲基辅助辅助酯和苯甲酸酯和苯甲酸酯配体衍生。 两种化合物均通过NMR光谱,红外光谱和X射线晶体学合成并充分表征。 在生理条件下,Ruofc和Ruobz Aquate的半衰期分别为2.9和6.5 h,以产生[RU 2(μ-N)(NH 3)8(H 2 O)2](OTF)5(RU265ʹ)和游离羧酸盐。 在N,Nʹ-二甲基甲酰胺(DMF)中RUOFC的环状伏安法揭示了在0.64 V VS SCE处的突出的可逆2E转移事件,对应于两种二甲苯基轴向轴向配体的同时氧化。 所有三个复合物还表现出不可逆的RU基于RU的减少,在–1 V Vs SCE的电位下。 RU265',RUOFC和RUOBZ的DFT计算确认RUOFC的氧化还原活性是由二革新配体引起的。 此外,这三种化合物的Lumo能量与它们不可逆的还原电位相关。 17,18抑制剂对于它们的应用是研究M Ca 2+摄取在细胞功能上的作用的工具。在这项研究中,我们报告了两个有效的MCU抑制剂,[RU 2(μ-N)(NH 3)8(FCCO 2)2](OTF)3(RUOFC,FC = Ferrecene,OTF = Triflate)和[RU 2(μ-N)(μ-N)(μ-N)(μ-n)(nh 3)(nh 3)8(phco 2)8(phco 2)2](phco 2](oobz)3(OOBZ)3(robz)。这些化合物是先前报道的抑制剂[RU 2(μ-N)(NH 3)8(Cl)2](Cl)3(RU265)的类似物,分别用铁甲基辅助辅助酯和苯甲酸酯和苯甲酸酯配体衍生。两种化合物均通过NMR光谱,红外光谱和X射线晶体学合成并充分表征。在生理条件下,Ruofc和Ruobz Aquate的半衰期分别为2.9和6.5 h,以产生[RU 2(μ-N)(NH 3)8(H 2 O)2](OTF)5(RU265ʹ)和游离羧酸盐。在N,Nʹ-二甲基甲酰胺(DMF)中RUOFC的环状伏安法揭示了在0.64 V VS SCE处的突出的可逆2E转移事件,对应于两种二甲苯基轴向轴向配体的同时氧化。所有三个复合物还表现出不可逆的RU基于RU的减少,在–1 V Vs SCE的电位下。RU265',RUOFC和RUOBZ的DFT计算确认RUOFC的氧化还原活性是由二革新配体引起的。此外,这三种化合物的Lumo能量与它们不可逆的还原电位相关。17,18对RU265,RUOFC和RUOBZ的生物学特性进行了系统的比较。RUOFC和RUOBZ都抑制了透化HEK293T细胞中M Ca 2+的摄取,但比RU265的有效性低5-7倍。在完整的细胞中,Ruobz被细胞吸收,并以与RU265相似的程度抑制MCU。RUOFC在RU265上表现出10倍的细胞摄取增加,这又导致完整细胞中MCU抑制活性的增强也适度。此外,与RU265相比,RUOFC对HEK293T和HELA细胞具有细胞毒性,其生长抑制浓度分别为23.2和33.9μm,可以利用该特性,这些特性可用于开发MCU推动的抗癌剂。这些结果将RUOFC作为一种有效的MCU抑制剂建立,并且是RU265的轴向配体功能化如何导致具有不同物理和生物学特性的新化合物的另一个例子。简介线粒体钙(M Ca 2+)在广泛的生物学过程中起重要作用,这对于细胞功能至关重要。1,2 M Ca 2+的摄取由线粒体钙Uniporter(MCU)实施,这是一种高度选择性的内部整流Ca 2+通道。3–5升高的M Ca 2+水平与多种病理状况有关,包括缺血再灌注损伤,8,9癌症,10-12和神经退行性疾病。13–16鉴于M Ca 2+参与这些人类疾病,人们对开发可以抑制MCU的化合物越来越兴趣,以防止M Ca 2+过载。13–16鉴于M Ca 2+参与这些人类疾病,人们对开发可以抑制MCU的化合物越来越兴趣,以防止M Ca 2+过载。
过敏反应中细胞外囊泡的蛋白质组织及其在血管通透性中的作用
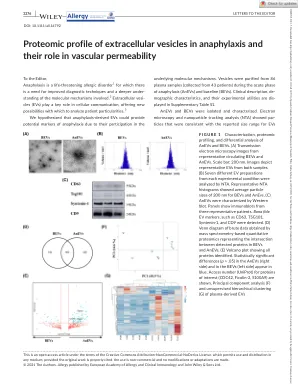
fi g u r e 1表征,蛋白质组学分析以及对ANEV和BEV的差分分析。(a)来自代表性循环BEV和ANEV的透射电子显微镜图像。比例尺:200 nm。图像描绘了来自两个样本的代表性电动汽车。(b)通过NTA分析了每个实验条件的七种不同的EV制剂。代表性的NTA直方图显示BEV和ANEVS的平均粒径为200 nm。(c)Anevs的特征是Western blot。面板显示三名代表性患者的免疫印迹。真正的EV标记,例如CD63,TSG101,Syntenin-1和CD9。(d)通过基于质谱的定量蛋白质组学获得的蛮数据的维恩图代表了BEV和ANEVS中检测到的蛋白质之间的相交。(e)火山图显示了所有鉴定的蛋白质。在ANEVS(右侧)和BEVS(左侧)中的统计学上显着差异(p> .05)以蓝色出现。访问数字(uniprot)显示了感兴趣的蛋白质(cdc42,ficolin-2,s100a9)。主成分分析(F)和血浆衍生EV的无监督分层聚类(G)
常规光子放射治疗后的血脑屏障通透性——临床和临床前研究的系统评价和荟萃分析
放射治疗 (RT) 是治疗脑肿瘤的基石。除了细胞毒性之外,RT 还会破坏血脑屏障 (BBB),导致周围脑实质的通透性增加。尽管这种影响已被普遍承认,但不同放射方案如何影响以及在多大程度上影响 BBB 完整性仍不清楚。本系统综述和荟萃分析的目的是研究光子 RT 方案在临床和临床前研究中对 BBB 通透性(包括其可逆性)的影响。我们系统地回顾了 PubMed、Embase 和 Cochrane 搜索引擎中的相关临床和临床前文献。通过荟萃分析对总共 69 项纳入研究(20 项临床研究、49 项临床前研究)进行了定性和定量分析,并评估了不同疾病类型和 RT 方案中 RT 诱导的 BBB 通透性的关键决定因素。定性数据综合显示,35% 的纳入临床研究报告了 RT 后 BBB 中断,而 30% 的研究尚无定论。有趣的是,基于分次方案和累积剂量计算出不同生物有效剂量的研究之间没有观察到明显差异;然而,在治疗后的患者随访期间注意到 BBB 中断增加。临床前研究的定性分析显示,78% 的纳入研究存在 RT BBB 中断,这通过荟萃分析得到显著证实(p < 0.01)。值得注意的是,研究之间存在高偏倚风险、出版偏倚和高度异质性。这项系统评价和荟萃分析揭示了 RT 方案对 BBB 完整性的影响,并开启了将此因素整合到未来 RT 决策过程的讨论,以更好地研究其发生及其对伴随或辅助治疗的影响。
线粒体通透性过渡决定了造血前体的细胞身份转换时线粒体成熟
线粒体通透性过渡孔(MPTP)是一个超分子通道,可调节跨cristae膜的溶质交换,在线粒体功能和细胞死亡中具有执行作用。MPTP对正常生理学的贡献仍然存在争议,尽管证据表明在区分祖细胞中的线粒体内膜重塑中MPTP。在这里,我们证明对MPTP电导的严格控制形成了代谢机制,因为细胞向造血身份转移。经历了内皮到山摩托型过渡(EHT)的细胞紧密控制MPTP的主要调节元件。在EHT期间,在造血性承诺之前,成熟的动脉内皮限制了MPTP活性。在细胞身份过渡后,MPTP电导恢复。在用NIM811治疗的子宫治疗中,NIM811是一种分子,该分子阻止了MPTP对通过环蛋白D(CYPD)开放的敏化,在造血前胞菌中扩增氧化磷酸化(OXPHOS),并增加了Embryo中造血性的造血性。此外,分化多能干细胞(PSC)在CYPD基因敲低PPIF后,更大的线粒体Cristae和造血活性的组织更大。相反,OPA1的敲低是适当的Cristae结构至关重要的GTPase,会诱发Cristae不规则性并损害造血。这些数据阐明了一种调节造血前体中线粒体成熟的机制,并强调了MPTP在获得造血命运中的作用。
博士项目:在TBI病理生物学和结果的进展中,血液脑屏障通透性操纵
选定的候选人将获得Trinity研究博士学位奖(TRDA),这是都柏林三一学院的开创性博士学位课程,为临床科学家,神经科学家,法律专家,政策制定者以及旨在确定大脑损害的临床科学家,法律专家,旨在认识大脑型标记的临床科学家,法律专家,构成了更广泛的跨学科培训和经验。loane-boto组中的特定学生将使用分子,流式细胞仪,成像和神经性方法的组合,以研究血脑屏障的破坏如何影响脑功能,以及如何操纵这种结构以恢复。