XiaoMi-AI文件搜索系统
World File Search System生物医学高级研究与发展局办公室
AOI #27:阻止二次传播 [S3] 阻断呼吸道病毒传播的药物医疗对策 呼吸道病毒病原体的人际传播会导致疫情/大流行、病毒进化以及出现抵抗治疗和逃避免疫的新菌株。阻断呼吸道疾病传播周期是公共卫生工作的重要组成部分,但目前的策略完全是非药物性质的(例如,戴口罩、保持社交距离、隔离)。目前的医疗对策(MCM;即疫苗和治疗)旨在预防严重的呼吸道疾病,但它们对病毒脱落/人际传播的影响各不相同。为此,阻止二次传播 (S3) 计划的总体目标是开发阻断呼吸道病毒病原体人际传播的新型 MCM。对于该计划,“传播阻断剂”可以:
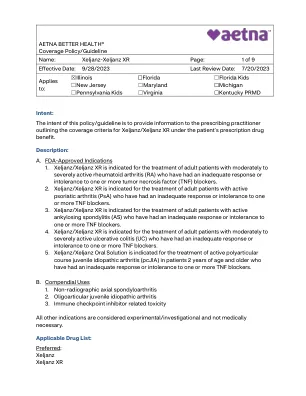
Xeljanz-Xeljanz Xr
1。Xeljanz/Xeljanz XR可用于治疗成年患者对一个或多个肿瘤坏死因子(TNF)阻滞剂的反应或不耐受性不足的成年患者(RA)。2。Xeljanz/Xeljanz XR用于治疗活性银屑病关节炎(PSA)的成年患者,他们对一个或多个TNF阻滞剂的反应或不耐受不足或不耐受。3。Xeljanz/Xeljanz XR被指示用于治疗成年患者的活跃性脊柱炎(AS),他们对一个或多个TNF阻滞剂的反应或不耐受不足。4。Xeljanz/Xeljanz XR可用于治疗成年患者对一个或多个TNF阻断剂的反应或不耐受性或不耐受性的成年患者(UC)。5。Xeljanz/Xeljanz口服溶液用于治疗2岁及以上患者的活性多关节特发性关节炎(PCJIA),他们对一个或多个TNF阻滞剂的反应或不耐受不足或不宽容。
人参皂苷、潜在的 TMPRSS2 抑制剂、抗 PD-1 免疫疗法与 COVID-19 治疗的联合治疗之间的权衡
方法:我们分析了 TMPRSS2 表达、甲基化水平、总体生存率、临床参数、生物学过程之间的相关性,并利用各种类型的生物信息学方法确定了 TMPRSS2 与腺癌 (LUAD) 和鳞状细胞癌 (LUSC) 肿瘤和邻近正常组织中的肿瘤内浸润淋巴细胞之间的相关性。此外,我们通过免疫组织化学分析确定了 TMPRSS2 蛋白水平与 LUAD 和 LUSC 队列预后的相关性。此外,我们使用癌症免疫图谱 (TCIA) 数据库来预测肺癌患者中 TMPRSS2 表达与程序性细胞死亡蛋白 1 (PD-1) 阻断剂免疫疗法反应之间的关系。最后,从同源性建模构建与 TMPRSS2 蛋白结合的人参皂苷的假定结合位点,以筛选高效 TMPRSS2 抑制剂。
免疫检查点抑制剂和急性间质性肾炎
免疫检查点抑制剂 (ICI) 是一类免疫治疗药物,它为多种恶性肿瘤(包括对传统疗法有耐药性或处于晚期的恶性肿瘤)提供了新的治疗选择,从而改变了癌症治疗。目前,它们单独使用或与其他治疗方法联合用于黑色素瘤、肺癌、肾细胞癌、膀胱癌和霍奇金淋巴瘤患者 [1,2]。ICI 是单克隆抗体,靶向 T 细胞、其他免疫细胞和肿瘤细胞上表达的抑制性受体。它们对被认为是适应性免疫反应重要突破点(或检查点)的分子具有抑制作用,如细胞毒性 T 淋巴细胞相关蛋白 4 (CTLA- 4)、程序性细胞死亡蛋白 1 (PD-1) 和程序性死亡配体 1 (PDL-1) [2]。CTLA-4 在 T 细胞上上调并与共刺激 CD28 配体分子竞争,导致抑制信号和 T 细胞停滞。 CTLA-4 阻断剂(例如
EZH2抑制剂联合TIGIT单克隆抗体对多发性骨髓瘤细胞的疗效研究
摘要:EZH2 是多梳抑制复合物 2 的成员之一,通过诱导下游基因组蛋白 3 位赖氨酸 27(H3K27me3)三甲基化来抑制肿瘤细胞增殖。本文表明,抑制 EZH2 后,细胞凋亡率和凋亡蛋白表达增加,而 NF- κ B 信号通路的关键分子和下游靶基因受到抑制。此外,mTOR 信号通路降低了多发性骨髓瘤 (MM) 细胞中 TIGIT 高亲和力配体 CD155 的表达。此外,EZH2 抑制剂和 TIGIT 单克隆抗体阻断剂的联合使用增强了自然杀伤细胞的抗肿瘤作用。综上所述,EZH2抑制剂不仅作为表观遗传药物发挥抗肿瘤作用,还可以通过影响NK细胞与MM细胞之间的TIGIT-CD155轴,增强TIGIT单抗的抗肿瘤作用,从而为MM患者的治疗提供新的思路和理论基础。
以谷氨酰胺代谢为目标作为癌症的治疗策略
增殖的癌细胞很大程度上依赖谷氨酰胺来存活和增殖。谷氨酰胺是 TCA 循环中脂质和代谢物合成的碳源,也是氨基酸和核苷酸合成的氮源。迄今为止,许多研究已经探索了谷氨酰胺代谢在癌症中的作用,从而为以谷氨酰胺代谢为靶点的癌症治疗提供了科学依据。在这篇综述中,我们总结了谷氨酰胺代谢每个步骤所涉及的机制,从谷氨酰胺转运蛋白到氧化还原稳态,并重点介绍了可用于临床癌症治疗的领域。此外,我们还讨论了癌细胞对以谷氨酰胺代谢为靶点的药物产生耐药性的机制,以及克服这些机制的策略。最后,我们讨论了谷氨酰胺阻断对肿瘤微环境的影响,并探索了最大限度发挥谷氨酰胺阻断剂作为癌症治疗效用的策略。
多伦多核事故应急响应计划
AAZ 自动行动区 BDBA 超出设计基准事故 CMOH 首席卫生官 CNSC 加拿大核安全委员会 CPZ 应急计划区 CRL 乔克河实验室 DNGS 达灵顿核电站 DPZ 详细规划区 EMCPA 应急管理和民事保护法 EIC 应急信息中心 EOC 应急行动中心 EPZ 应急计划区 IPZ 摄入计划区 ITB 碘甲状腺阻断剂 KI 碘化钾 km 公里 LGIC 副总督会同枢密院 MCSCS 社区安全和惩教服务部 MDU 监测和净化单位 MOHLTC 卫生和长期护理部 MTO 安大略省交通部 NEMCC 核应急管理协调委员会 PEOC 省应急行动中心 PNERP 省核应急响应计划 PNGS 皮克林核电站 PPE 个人防护设备 RD 放射设备 UTCC 统一交通协调中心 UTMP 统一交通管理计划
UOR职位描述和人员规格 - 工作@Reading
•具有适当的荧光标记物的电压门控钙通道CACNA1C和CACNA1B同工型的瞬时转染稳定或瞬时表达VGCC和22亚基,用于形成功能通道所必需的SHEK293细胞。•表现出感兴趣变化的同工型将作为可诱导的稳定转染细胞系产生,以进行进一步的实验。•体外电生理学(全细胞贴片夹记录)测量生物物理参数,包括电压敏感性,电导和激活/失活动力学。•使用接近连接测定和细胞表面生物素化来鉴定新型相互作用蛋白,以测定离子通道运输到膜上。•使用包括L型钙通道的选择性阻断剂在内的一系列药物进行了VGCC蛋白质成型的药理学的解剖。•分析描述性数据,数字图像和遗传数据的电生理学,蛋白质生物化学和药理学数据集•数据交流和写作研究论文手稿。
INBRX- 120,一种靶向 CD8α 的失谐 IL
摘要 背景 作为淋巴细胞增殖和活化的主要驱动因素,白细胞介素 2 (IL-2) 是抗肿瘤反应的关键介质。尽管在部分患者中表现出良好的活性,但 IL-2(阿地白介素)的更广泛治疗效用受到严重的剂量限制性毒性、免疫抑制调节性 T 细胞的扩增和较差的药代动力学 (PK) 特征的阻碍。最近的工程改造努力,包括非 α IL-2 变体,已经降低了毒性特征,但尚未在更广泛的患者群体中诱导有意义的抗肿瘤活性。方法我们设计了 INBRX-120,一种 CD8 α 靶向 Cisleukin™ 分子,由亲和力调节的 IL-2 (IL2-x) 通过效应沉默的 Fc 结构域连接到两个高亲和力 CD8 α 特异性单域抗体组成。为了证明这种巨大的亲和力差异能够使 IL- 2 顺式信号传导专门作用于表达 CD8 α 的杀瘤效应细胞群,我们在体外测试了 INBRX-120 对靶细胞扩增、活化和抗肿瘤活性的影响。在同源小鼠模型中单独或与程序性细胞死亡蛋白 1 (PD-1) 阻断剂联合使用评估了体内抗肿瘤功效。在非人类灵长类动物中进行了临床前安全性以及药效学 (PD) 和 PK 分析。结果 INBRX-120 有效扩增和增强了 CD8 T 细胞和自然杀伤细胞对肿瘤细胞的细胞毒能力,而不会在体外和体内影响调节性 T 细胞。在同源小鼠模型中,INBRX-120 替代品单独使用和与 PD-1 阻断剂联合使用均表现出安全、有效和持久的抗肿瘤功效。在非人类灵长类动物中,INBRX-120 扩增并激活了表达 CD8 α 的效应细胞,显示出良好的 PK 特性,并且在剂量高达 1 mg/kg 时耐受性良好。结论通过其对表达 CD8 α 的效应细胞的独特顺式信号传导活性,INBRX-120 克服了基于 IL-2 的疗法的主要局限性,并有效地利用了 IL-2 强大的内在抗肿瘤活性。这种新颖的治疗策略有望实现更安全的临床活性,可在更广泛的各种癌症适应症患者中诱导有意义的抗肿瘤疗效。