XiaoMi-AI文件搜索系统
World File Search System阿尔茨海默氏病中溶酶体酶基因的单倍症
。cc-by-nd 4.0国际许可证(未经同行评审证明)获得的是作者/资助者,他已授予Biorxiv的许可证,以永久显示预印本。这是该版本的版权持有人,该版本发布于2024年11月18日。 https://doi.org/10.1101/2024.11.16.623962 doi:Biorxiv Preprint
本文综述了结构磁共振成像在常见神经精神类疾病中的应用
[3] LIBOWITZ MR,WEI K,TRAN T,et al.Regional brain volumes relate to Alzheimer's disease cerebrospinal fluid biomarkers and neuropsychometry:A cross-sectional,observational study[J].PLoS One,2021,16(7):e0254332.[4] 王含春 , 汪群芳 , 罗长国 , 等 .磁共振薄层扫描结合人工智能脑结构分割技术分析海马体积辅 助诊断脑小血管病认知功能障碍 [J].全科医学临床与教育 ,2024,22(3):208-211.[5] 姜华 , 宛丰 , 吕衍文 , 等 .2 型糖尿病伴认知功能障碍患者基于体素的脑形态学 MRI 研究 [J].中 国 CT 和 MRI 杂志 ,2018,16(4):22-25.[6] 景赟杭 , 郭瑞 , 常轲 , 等 .2 型糖尿病性认知功能障碍脑结构 MRI 成像研究进展 [J].延安大学学 报(医学科学版) ,2024,22(1):88-91,107.[7] 郭浩 , 和荣丽 .磁共振成像对老年性痴呆患者海马解剖结构的评估价值研究 [J].磁共振成 像 ,2022,13(8):75-79.[8] 罗财妹 , 李梦春 , 秦若梦 , 等 .阿尔茨海默病谱系患者的海马亚区体积损害特征 [J].中风与神经 疾病杂志 ,2019,36(12):1097-1101.[9] 冯伦伦 , 金蓉 , 曹城浩 , 等 .阿尔茨海默病患者认知功能减退的海马亚区结构改变分析 [J].临床 放射学杂志 ,2022,41(10):1819-1824.[10] WEI Y,HUANG N,LIU Y,et al.Hippocampal and Amygdalar Morpho logical Abnormalities in Alzheimer,s Disease Based on Three Chinese MRI Datasets[J].Curr Alzheimer Res,2020,17:1221-1231 . [11] ESTEVEZ S S,JIMENEZ H A,ADNI G.Comparative analy sis of methods of volume adjustment in hippocampal volumetry for the diagnosis of Alzheimer disease[J].Neuroradiol,2020;47(2):161-5.[12] 曾利川 , 王林 , 廖华强 , 等 .结构与功能磁共振成像在轻度认知障碍及阿尔茨海默病中的应 用 [J].中国老年学杂志 ,2021,41(13):2902-2907.[13] KODAM P,SAI S R,PRADHAN S S,et al.Integrated multi-omics analysis of Alzheimer's disease shows molecular signatures associated with disease progression and potential therapeutic targets[J].Sci Rep,2023,13(1):3695.[14] 黄建 , 王志 .复杂网络分析技术在阿尔兹海默症患者脑结构和功能影像中的应用进展 [J].中 国医学物理学杂志 ,2024,41(8):1053-1055.[15] JELLINGER K A.The pathobiological basis of depression in Parkinson disease:challenges and outlooks[J].J Neural Transm(Vienna),2022,129(12):1397-1418.[16] BANWINKLER M,THEIS H,PRANGE S,et al.Imaging the limbic system in Parkinson's disease-A review of limbic pathology and clinical symptoms[J].Brain Sci,2022,12(9):1248.[17] 程秀 , 张鹏飞 , 王俊 , 等 .小脑结构与功能磁共振成像在帕金森病中的研究进展 [J].磁共振成 像 ,2022,13(4):146-149.[18] CUI X,LI L,YU L,et al.Gray Matter Atrophy in Parkinson's Disease and the Parkinsonian Variant of Multiple System Atrophy:A Combined ROI-and Voxel-Based Morphometric Study[J].Clinics(Sao Paulo),2020,75:e1505.[19] LOPEZ A M,TRUJILLO P,HERNANDEZ A B,et al.Structural Correlates of the Sensorimotor Cerebellum in Parkinson's Disease and Essential Tremor[J].Mov Disord,2020,35(7):1181-1188.[20] 鲍奕清 , 王二磊 , 邹楠 , 等 .帕金森病伴疲劳患者的大脑功能与结构磁共振成像研究 [J].临床 放射学杂志 ,2024,43(8):1265-1270.[21] 邹楠 , 王二磊 , 张金茹 , 等 .帕金森病伴疼痛患者大脑皮层厚度改变的结构 MRI 研究 [J].磁共 振成像 ,2024,15(5):13-18,23.[22] 屈明睿 , 高冰冰 , 苗延巍 .帕金森病伴抑郁在脑边缘系统结构及功能改变的 MRI 研究进展 [J].磁共振成像 ,2023,14(12): 127-131.
阿尔茨海默病
痴呆症是全球主要的健康问题之一。世界卫生组织的 2022 年蓝图显示,预计全球将有约 5520 万人患痴呆症。然而,60 岁以上人群的痴呆症患病率也存在地区差异。欧洲报告的发病率为 6.5%,东南亚为 2.9%,其他地区为 3.1% 至 5.7%。最常见的痴呆症形式是阿尔茨海默病 (AD) [1],约占痴呆症病例的 60-70%。自 20 世纪初没有有效的药物可以有效治愈 AD 以来,AD 在老年人口中一直很普遍。过去 20 年来,AD 的患病率一直在上升。2010 年,报告的病例约为 3600 万例,预计到 2030 年,这一数字可能达到 6570 万例 [2]。
阿尔茨海默病
摘要 阿尔茨海默病 (AD) 是老年期最常见的痴呆症。除了脑淀粉样蛋白的积聚,还有多种因素导致 AD 病理,包括血管改变、全身炎症、遗传/表观遗传状态和线粒体功能障碍。目前,人们在神经炎症方面投入了大量精力。然而,抗炎药物和许多其他疗法(主要针对 β-淀粉样蛋白)均未能对 AD 显示出有效的作用。时机、适当的患者选择以及多靶点方法的必要性似乎是当前治疗努力的主要弱点。如果有有效的生物标志物,治疗的疗效可以得到更好的评估。我们在此建议在 AD 中应用精准医疗原则,根据个性化的生物标志物指导的靶向疗法同时验证治疗的疗效和特定生物标志物的可靠性。有患 AD 风险或处于疾病早期阶段的人应根据以下标准进行分层:(1) 神经心理学测试; (2) 载脂蛋白 E (ApoE) 基因分型;(3) 血浆和脑脊液 (CSF) 生化分析;(4) MRI 和正电子发射断层扫描;(5) 通过整合血浆、脑脊液中的各种遗传和生化参数以及微生物组成分析来评估其炎症特征。应在随机、纵向、安慰剂对照研究中使用特设特征(例如血管特征、线粒体特征等)对选定人群进行抗淀粉样变性和抗炎药物治疗。如果这些标准被广泛采用并共享结果,则可能迅速开发出创新和个性化的药物治疗方案,并且更有可能真正有效。
引起自闭症的蛋白质涉及男性不育症
不育症是一个研究领域,近年来一直引起关注,以及出生率下降的问题。另一方面,自闭症是一种发育障碍,具有诸如沟通障碍和有限的利益和偏好之类的特征,并且是干扰社会生活的疾病,随着患者的数量增加,它已成为一个主要的社会问题。尽管最近有几份报告表明自闭症患者的妊娠率较低,但目前尚不清楚这两种疾病是如何相关的。该研究小组的重点是蛋白质CHD8,这是自闭症患者中最常见的突变。结果,我们发现引起自闭症的蛋白质CHD8不仅在大脑中,而且在睾丸,生殖器中都强烈表达。此外,当CHD8缺乏生殖细胞时,睾丸显着降低,导致不育,几乎没有生成精子。特别是,发现缺乏CHD8的生殖细胞会干扰减数分裂的进展(*2)。此外,基因表达分析表明,CHD8调节PRDM9(*4)的表达水平,一种组蛋白甲基化修饰酶,即使在转移期间,DNA双链断裂也需要DNA双链断裂(*3)。我们发现CHD8通过调节PRDM9调节减数分裂的进展,并且对正常的精子发生至关重要。有趣的是,已知CHD8通过组蛋白甲基化修饰参与自闭症的发展。在这项研究中,我们发现CHD8通过组蛋白甲基化修饰的共同机制有助于不同疾病(例如自闭症和不育)的发展。预计这项研究将导致治疗的发展,并阐明已成为自闭症和不育等主要社会问题的疾病机制。
海事学校战略研究
8 Takei Tomohisa,“海上新时代的海上自卫力量 - 新海上时代的JMSDF”,“ Hato”,vol。 34,第4号,2008年,第2-29页; Saito Satoshi,“ Reiwa中的海上自卫队 - 其努力的方向”,“海上学校战略研究”,第1卷。 10,第1、2020页,第7-19页; Omachi Katsushi,“新时代的海洋自卫力量作为海力量”,“海上学校战略研究”,第1卷。 11,第1期,2021年,第12-39页;此外,这些实现的三个目标是由海上自卫队授权为组织的目标。 “迈向免费开放的海洋 - 海上自卫力量之战的指南”(“海上自卫力战略指南”)海上自卫队,https://wwwwww.mod.go.go.jp/msdf/msdf/msdf/msdf/about/guideline/,2024年1月11日,2024年1月11日。
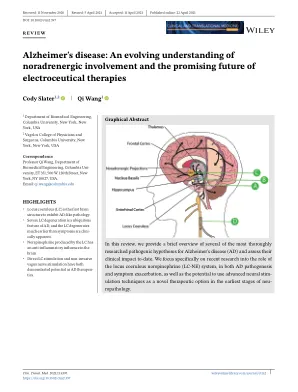
阿尔茨海默氏病
阿尔茨海默氏病(AD)是21世纪的重大公共卫生挑战。本文深入研究了AD的神经退行性复杂性,突出了认知能力下降,记忆力障碍和社会负担。从机械上讲,讨论了蛋白质错误折叠,淀粉样蛋白β(Aβ)途径异常和遗传/环境因素。剖析了关键淀粉样假说,重点是β聚集在突触功能障碍和神经变性中的作用。评论展示了有希望的治疗策略,包括抗淀粉样抗体和靶向Aβ产生的β /γ-分泌酶抑制剂。值得注意的是,FDA-批准的lecanemab表示突破,疾病的进展减慢。强调了抗TAU疗法的出现,以解决晚期干预。tau聚集阻滞剂和抗TAU抗体提供了针对细胞内TAU病理学的潜力。评论强调了揭示AD秘密的合作努力,并为保存记忆铺平了道路。
阿尔茨海默氏病
重点介绍了痴呆症的临床综合征的特征是两个或多个认知领域的逐渐下降,包括但不限于语言,记忆,执行功能,个性或行为。1阿尔茨海默氏病(AD)在痴呆症的临床陈述中起着重要作用,占所有Demen TIA诊断的80%。2仅在美国,据估计,2010年从广告中获得了65岁以上的470万个人,预计到2050年,有1380万美国人将与AD一起生活。3 AD在2010年在美国的第六大死亡原因也被评为第六大死亡原因,归因于该疾病的84,000多人死亡,比去年增加了3.7%。4 AD的总体经济负担也很大,导致每年1000亿美元的成本,在美国第三,仅次于心脏病和癌症。5,全球影响甚至更严重,2012年最多2400万例。该数字预计每20年将翻一番,直到至少2040年。6
探索阿尔茨海默病
痴呆症是一项日益严重的全球健康挑战,其中阿尔茨海默病 (AD) 是首当其冲的疾病。大量证据表明,AD 相关的病理蛋白在特定大脑区域积累,随后沿着大脑网络扩散到更广泛的区域,导致单个大脑区域及其互连中断。虽然对神经退行性疾病与大脑网络之间的联系还缺乏全面的了解,但不可否认的是,大脑网络在 AD 的发展和进展中起着关键作用。为了彻底阐明构成人类大脑的复杂元素和连接网络,引入了大脑连接组的概念。基于连接组的研究在揭示疾病发展机制方面具有巨大潜力,已成为众多研究人员关注的热门话题。在本文中,我们旨在系统地总结 AD 背景下的脑网络研究,批判性地分析现有方法的优势和劣势,并提供新的观点和见解,以期为未来的研究提供启发。