XiaoMi-AI文件搜索系统
World File Search System阿尔茨海默氏病和2型糖尿病
参考文献1。Dela Monte SM,Wands Jr。阿尔茨海默氏病是经过3型糖尿病的证据。J糖尿病SCI技术。2008; 2(6):1101-13。 2。 Salas IH,De Strooper B.糖尿病和阿尔茨海默氏病:这种联系并不像看起来那么简单。 Neurochem res。 2019; 44(6):1271-8。 3。 Xue A,Wu Y,Zhu Z,Zhang F,Kemper KE,Zheng Z等。 全基因组关联分析确定了2型糖尿病的143种风险变异和推定的调节机制。 nat Commun。 2018; 9(1):2941。 4。 Bellenguez C,Kucukali F,Jansen IE,Kleineidam L,Moreno-Grau S,Amin N等。 对阿尔茨海默氏病和相关痴呆症的遗传病因的新见解。 nat Genet。 2022; 54(4):412-36。 5。 Kunkle BW,Grenier-Boley B,Sims R,Bis JC,Damotte V,Naj AC等。 对被诊断的阿尔茨海默氏病的遗传元分析确定了新的风险基因座,并暗示了Abeta,Tau,免疫和脂质加工。 nat Genet。 2019; 51(3):414-30。 6。 Hao K,Di Narzo AF,Ho L,Luo W,Li S,Chen R等。 共享阿尔茨海默氏病和2型糖尿病的基础遗传病因。 摩尔方面医学。 2015; 43-44:66-76。2008; 2(6):1101-13。2。Salas IH,De Strooper B.糖尿病和阿尔茨海默氏病:这种联系并不像看起来那么简单。Neurochem res。2019; 44(6):1271-8。 3。 Xue A,Wu Y,Zhu Z,Zhang F,Kemper KE,Zheng Z等。 全基因组关联分析确定了2型糖尿病的143种风险变异和推定的调节机制。 nat Commun。 2018; 9(1):2941。 4。 Bellenguez C,Kucukali F,Jansen IE,Kleineidam L,Moreno-Grau S,Amin N等。 对阿尔茨海默氏病和相关痴呆症的遗传病因的新见解。 nat Genet。 2022; 54(4):412-36。 5。 Kunkle BW,Grenier-Boley B,Sims R,Bis JC,Damotte V,Naj AC等。 对被诊断的阿尔茨海默氏病的遗传元分析确定了新的风险基因座,并暗示了Abeta,Tau,免疫和脂质加工。 nat Genet。 2019; 51(3):414-30。 6。 Hao K,Di Narzo AF,Ho L,Luo W,Li S,Chen R等。 共享阿尔茨海默氏病和2型糖尿病的基础遗传病因。 摩尔方面医学。 2015; 43-44:66-76。2019; 44(6):1271-8。3。Xue A,Wu Y,Zhu Z,Zhang F,Kemper KE,Zheng Z等。全基因组关联分析确定了2型糖尿病的143种风险变异和推定的调节机制。nat Commun。2018; 9(1):2941。4。Bellenguez C,Kucukali F,Jansen IE,Kleineidam L,Moreno-Grau S,Amin N等。对阿尔茨海默氏病和相关痴呆症的遗传病因的新见解。nat Genet。2022; 54(4):412-36。5。Kunkle BW,Grenier-Boley B,Sims R,Bis JC,Damotte V,Naj AC等。对被诊断的阿尔茨海默氏病的遗传元分析确定了新的风险基因座,并暗示了Abeta,Tau,免疫和脂质加工。nat Genet。2019; 51(3):414-30。 6。 Hao K,Di Narzo AF,Ho L,Luo W,Li S,Chen R等。 共享阿尔茨海默氏病和2型糖尿病的基础遗传病因。 摩尔方面医学。 2015; 43-44:66-76。2019; 51(3):414-30。6。Hao K,Di Narzo AF,Ho L,Luo W,Li S,Chen R等。 共享阿尔茨海默氏病和2型糖尿病的基础遗传病因。 摩尔方面医学。 2015; 43-44:66-76。Hao K,Di Narzo AF,Ho L,Luo W,Li S,Chen R等。共享阿尔茨海默氏病和2型糖尿病的基础遗传病因。摩尔方面医学。2015; 43-44:66-76。2015; 43-44:66-76。
绘制阿尔茨海默氏病和痴呆症
。 17117 Sanitaria医院28041年10月12日,西班牙马德里; sara.llas@salut.org(s.-v.);阿尔贝托。苏里德,马德里。 28029马德里。); barbababus@us.s(B.B.-V。)
基于阿尔茨海默氏病的生物标志物
1。Hansson O.神经退行性疾病的生物标志物。nat Med。2021; 27:954-963。 doi:10.1038/s41591-021-01382-x 2。Villemagne VL,Burnham S,Bourgeat P等。淀粉样蛋白β沉积,神经退行性变化和零星阿尔茨海默氏病的认知下降:一项前瞻性队列研究。柳叶刀神经。2013; 12:357-367。 doi:10.1016/s1474-4422(13)70044-9 3。 2023阿尔茨海默氏病的事实和数字。 阿尔茨海默氏症痴呆症。 2023; 19:1598-1695。 doi:10.1002/alz.13016 4。 Drabo EF,Barthold D,Joyce G,Ferido P,Chang Chui H,Zissimopoulos J.种族多样的医疗保险受益人对痴呆症诊断和专业护理的纵向分析。 阿尔茨海默氏症痴呆症。 2019; 15:1402-1411。 doi:10.1016/j.jalz.2019.07.005 5。 paczynski MM,Day GS。 临床实践中的阿尔茨海默氏病生物标志物:基于血液的诊断革命。 J Prim Care Commu-2013; 12:357-367。 doi:10.1016/s1474-4422(13)70044-9 3。2023阿尔茨海默氏病的事实和数字。阿尔茨海默氏症痴呆症。2023; 19:1598-1695。 doi:10.1002/alz.13016 4。Drabo EF,Barthold D,Joyce G,Ferido P,Chang Chui H,Zissimopoulos J.种族多样的医疗保险受益人对痴呆症诊断和专业护理的纵向分析。阿尔茨海默氏症痴呆症。2019; 15:1402-1411。 doi:10.1016/j.jalz.2019.07.005 5。 paczynski MM,Day GS。 临床实践中的阿尔茨海默氏病生物标志物:基于血液的诊断革命。 J Prim Care Commu-2019; 15:1402-1411。 doi:10.1016/j.jalz.2019.07.005 5。paczynski MM,Day GS。临床实践中的阿尔茨海默氏病生物标志物:基于血液的诊断革命。J Prim Care Commu-
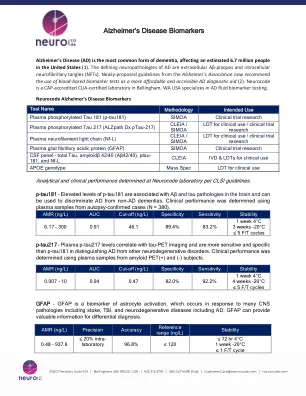
阿尔茨海默氏病生物标志物
阿尔茨海默氏病(AD)是痴呆症最常见的形式,影响了美国的670万人(1)。AD的定义神经病理是细胞外Aβ-Plaques和细胞内神经原纤维缠结(NFTS)。阿尔茨海默氏症协会的新指南现在建议使用基于血液的生物标志物测试作为一种更实惠,更便宜的AD诊断辅助工具(2)。Neurocode是美国华盛顿州贝灵汉的CAP认证实验室,专门研究AD流体生物标志物测试。
阿尔茨海默氏病和癫痫用例
脑电图(EEG)被广泛用作一种非侵入性技术,用于诊断几种脑部疾病,包括阿尔茨海默氏病和癫痫病。直到最近,人类专家已经通过脑电图读数发现了疾病,这不仅可能是特定的,而且很难找到,而且还会遭受人为错误。尽管最近出现了用于解释脑电图的机器学习方法,但大多数方法无法捕获人脑不同区域中信号之间的基本任意非欧几里得关系。在这种情况下,图形神经网络(GNN)因其在不同类型的图形结构数据中有效分析复杂关系的能力而引起了人们的关注。这包括脑电图,一个用例相对尚未探索。在本文中,我们旨在通过提出一项研究的研究来弥合这一差距,该研究应用于基于脑电图的阿尔茨海默氏病的检测以及对两种不同类型的癫痫发作的歧视。为此,我们通过证明单个GNN体系结构在两种用例中都可以实现最新性能来证明GNN的价值。通过设计空间探索和解释性分析,我们开发了一种基于图形的变压器,该变压器在阿尔茨海默氏病的三元分类变体和癫痫用例的三元分类变体中,可实现超过89%和96%的交叉验证准确性,与专家学家绘制的直觉相匹配。我们还讨论了GNN对脑电图的实时操作的计算效率,概括性和潜力,将其定位为分类各种神经病理学的宝贵工具,并为研究和临床实践开辟了新的前景。
对阿尔茨海默氏病的韧性概念
©作者2024。Open Access本文是根据Creative Commons Attribution 4.0 International许可获得许可的,该许可允许以任何媒介或格式使用,共享,适应,分发和复制,只要您对原始作者和来源提供适当的信誉,请提供与创意共享许可证的链接,并指出是否进行了更改。本文中的图像或其他第三方材料包含在文章的创意共享许可中,除非在信用额度中另有说明。如果本文的创意共享许可中未包含材料,并且您的预期用途不受法定法规的允许或超过允许的用途,则您需要直接从版权所有者那里获得许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/4.0/。Creative Commons公共领域奉献豁免(http://creativecom- mons.org/publicdomain/zero/zero/1.0/)适用于本文中提供的数据,除非在信用额度中另有说明。
阿尔茨海默氏病的基因检测
患有早期家庭AD的个体(即65岁之前,但最早30岁)构成了一小部分AD患者。可能显示出常染色体的遗传模式。在受影响的家族中已经鉴定出三个基因的致病突变:淀粉样蛋白β前体蛋白基因(APP),Presenilin 1(PSEN1)基因和Presenilin 2(PSEN 2)基因。APP和PSEN1致病变异具有100%的其他原因死亡,而PSEN 2具有95%的渗透率。这些基因中的各种变体与AD相关。 PSEN1中的变体似乎是最常见的。虽然只有3%–5%的AD患者患有早期疾病,但在这些患者中,已确定了多达70%或更多的病原变异。可识别的遗传变异是AD的罕见原因。
阿尔茨海默氏病的干细胞疗法
一种无法治愈的神经发生疾病,阿尔茨海默氏病,是全球健康,医疗和社会灾难的原因。两个主要症状是认知障碍和神经元丧失。靶向tau蛋白缠结和β斑块的当前药物不是很有效,因为它们仅放慢AD的症状并且不修复受损的细胞。然而,基于干细胞的治疗构成了AD治疗的另一种策略。 他们有能力分为专门的成年细胞,具有自我更新能力和乘法。 由于干细胞技术的发展,干细胞现在可以用作细胞治疗的供体来源。 本综述涵盖了基于靶向tau蛋白缠结和β斑块的研究的临床前和临床更新,以及在AD处理中使用的四种干细胞。 审查还概述了AD的两个基本病理方面,Tau蛋白缠结和β斑块。基于干细胞的治疗构成了AD治疗的另一种策略。他们有能力分为专门的成年细胞,具有自我更新能力和乘法。干细胞现在可以用作细胞治疗的供体来源。本综述涵盖了基于靶向tau蛋白缠结和β斑块的研究的临床前和临床更新,以及在AD处理中使用的四种干细胞。审查还概述了AD的两个基本病理方面,Tau蛋白缠结和β斑块。
阿尔茨海默病和相关痴呆症的死后脑成像:南德克萨斯州阿尔茨海默病研究中心资料库
a 美国德克萨斯州圣安东尼奥市德克萨斯大学圣安东尼奥健康科学中心格伦·比格斯神经退行性疾病研究所 b 美国德克萨斯州圣安东尼奥市德克萨斯大学圣安东尼奥健康科学中心研究成像研究所 c 美国德克萨斯州圣安东尼奥市德克萨斯大学健康科学中心神经病学系 d 美国德克萨斯州加尔维斯顿市德克萨斯大学医学分校神经病学系 e 美国德克萨斯州哈林根市德克萨斯大学里奥格兰德河谷分校医学院神经科学系 f 美国德克萨斯州布朗斯维尔市德克萨斯大学里奥格兰德河谷分校医学院人类遗传学系 g 美国纽约州纽约市西奈山伊坎医学院病理学系 h 美国德克萨斯州圣安东尼奥市德克萨斯大学健康科学中心病理学系
通过 DNA 甲基化和人工智能技术识别阿尔茨海默病
摘要:本文介绍了一种非线性方法,用于识别 CpG DNA 甲基化数据组合作为阿尔茨海默病 (AD) 的生物标记。本文将展示所提出的算法可以大幅减少使用的 CpG 数量,同时生成的预测比使用所有可用的 CpG 更准确。假设该过程原则上可以是非线性的;因此,非线性方法可能更合适。所提出的算法选择将哪些 CpG 用作分类问题的输入数据,该分类问题试图区分患有 AD 的患者和健康对照个体。这种类型的分类问题适用于支持向量机等技术。该算法既可用于单个数据集级别,也可用于多个数据集。开发适用于多数据集的稳健算法具有挑战性,因为实验室程序中的细微差异会对获得的数据产生影响。本文中采用的方法可以扩展到多个数据集,从而可以逐步更细致地了解底层过程。使用所提出的方法,获得了 92% 的成功分类率,这一值高于使用所有可用 CpG 获得的结果。这可能是由于该算法降低了数据维度,从而有助于降低达到局部最小值的风险。