XiaoMi-AI文件搜索系统
World File Search System帕西帕尼-特洛伊山镇 - 总体规划
根据新泽西州《市政土地使用法》(MLUL)的规定,总体规划的基本目的是“以保护公众健康和安全并促进公共福利的方式指导市政当局内的土地使用”。该镇上一次进行全面的总体规划是在 1976 年,从那时起,根据 MLUL 的规定,定期完成重新审查报告,审查总体规划并根据社区的变化重新考虑目标。规划委员会必须至少每 10 年准备一次重新审查报告。最近的重新审查报告于 2014 年和 2019 年完成。2020 年总体规划重新审查报告旨在为经济适用房的监管变化提供政策基础。建议涉及满足镇区对经济适用房公平份额义务所需的行动。涉及其他重点领域的规划建议被推迟到这一完整的总体规划工作中。
帕尼帕特的社会循环经济:绿色和
当前的“获取-制造-处置”经济模式依赖于廉价、易得的材料和资源,经常受到供应链风险的影响,而且在环境和经济方面都极其浪费和不可持续。供应链风险的增加、价格波动和自然资源可用性的下降,增加了循环经济模式的重要性。成功的循环经济模式形成一个闭环,在设计上具有恢复性和再生性。它旨在使产品、材料和组件保持其最高价值和效用 4 。通过采用循环商业模式,不仅可以解决资源效率、污染等可持续发展问题,还可以有效解决减少失业和改善利益相关者生计等问题。
为了美属萨摩亚人民,帕果帕果。
灰色的城堡庄严地悬挂着 26 面鲜艳的旗帜,上面画着威尔士巨龙和纹章盾牌,这里将成为皇家庆典的场地。身穿中世纪外袍的传令官、身穿长袍的贵族、女王陛下的治安官、市长和私人官员将为它们加油助威。
帕唑帕尼诱发手足皮肤反应
手足综合征又称掌跖红斑、掌跖红斑、手掌和足底毒性红斑或 Burgdorf 综合征,是一种常见的化疗药物皮肤反应。手足综合征会影响手掌、足底、手足背侧、咬合、摩擦和受压区域。手掌和足底会出现对称性红斑和水肿,并伴有神经性疼痛。它可能发展为脱屑、糜烂和溃疡,并形成水疱。手掌比足底更易受到影响。最常见的致病药物为阿霉素、脂质体阿霉素、多西他赛、5-氟尿嘧啶(5-FU)、阿糖胞苷、卡培他滨,但也可由紫杉醇、羟基脲、甲氨蝶呤、6-巯基嘌呤、环磷酰胺、顺铂、柔红霉素、依托泊苷、长春瑞滨、伊立替康、表柔比星等药物引起。近年来,随着多激酶抑制剂在肿瘤学中的应用,已报道了具有独特临床特征的掌跖反应。帕唑帕尼是一种多靶点酪氨酸激酶抑制剂,可引起手足皮肤反应,表现为手足红斑、角化结节、大疱、疼痛和刺痛感。如果在开始使用帕唑帕尼治疗后发现手或脚出现此类变化,则应评估患者是否有副作用。必要时应调整治疗,严重者应考虑停用帕唑帕尼。我们介绍了一例因帕唑帕尼而导致手足皮肤反应的病例。
胡志明市里帕
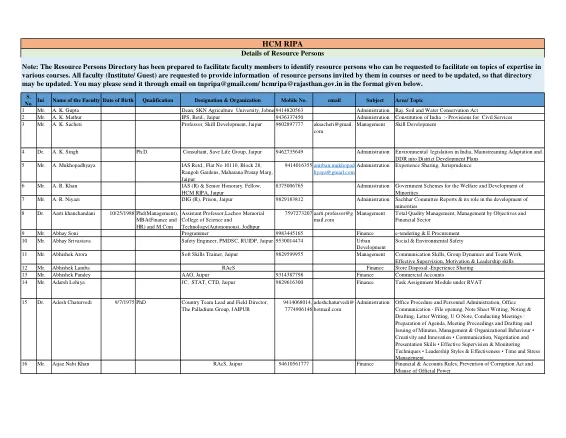
RTS®,斋浦尔 982927707 管理 土地记录管理、土地记录练习、土地记录的调查与维护以及拉贾斯坦邦土地收入(调查、记录和结算)政府规则和土地收入管理:一般介绍(I)和(II) 151 Mr. Gopal Vijay 斋浦尔 9414030055 财务会计、剩余物资处理、库存控制技术 152 Dr. Gordhan Lal Sharma 博士RAS,分区官员,Chaksu (Jaip7742321377 行政管理 SDO 在地区管理中的作用以及公平补偿权利和土地征用、恢复和重新安置法案的透明度,2013 年(第一部分和第二部分)以及一般规则(民事)和问题解决 153 Govind Beniwal 先生,联合国儿童基金会项目主任,斋浦尔 9983888866 性别/儿童权利
帕多亚大学
标题单击磷脂合成的化学,以研究与EPR和Cryo-Em方法研究脂质 - 蛋白质的相互作用,支持者Gabriele Giachin Research Group研究小组生物分类结构联系网络:电子邮件:Gabriele.giachin.giachin@unipd.it@unipd.it copropont.it Marco Bortolus Research Group epr SpectReprspross Eprsprspross epr Spect eprsproseps epr spect epr spect eprsprops epr spect eprsproppopy eprsproppopy Web网络https://wwwdisc.chimica.unipd.it/eprlab/?page_id=111电子邮件:marco.bortolus@unipd.it Internationalsectment PI. Sebastian Glatt Institute Malopolska生物技术中心生物技术中心,Jagiellonian University,Jagiellonian University,Countrant Countrant,Countrand of Countrand of Countrand,Poland sectuds#3)生物分子的神秘类别。虽然脂质众所周知是膜结构和储能的基本单位,但它们也可以充当执行变构功能和信号传导的化学使者,并且是蛋白质稳定性和折叠的结构元素。解密不同脂质物种的确切作用和生物学相互作用已被证明难以捉摸。脂质很难研究的原因之一是相对缺乏既缺乏质疑动态并在结构层面上可视化它们的技术。在过去的几十年中,随着化学和合成生物学和新型化学技术的强大工具的研究,基于脂质的探针已变得越来越普遍,用于研究体外和体内脂质。脂质组学的应用包括,例如,了解脂质生物合成,贩运和信号的基本细胞生物学,但也发展了癌症药物递送系统。在细胞中,膜中的精确而复杂的磷脂组成对于线粒体功能至关重要。线粒体是细胞的“动力”,磷脂可能会影响包括呼吸链超复合物在内的蛋白质复合物的活性,生物发生和稳定性。尤其是,几种磷脂分子与复合物I(NADH:泛氨基氧化还原酶)交织在一起,这是呼吸链的入口点,是我们细胞的最大膜相关酶(1 MDA)。复合物I的功能障碍与儿童相关的遗传疾病和成人神经退行性综合症有关。脂质可以调节复合物活性,而不是其在维持线粒体膜完整性中的作用。需要进一步研究脂质如何调节CI组装或功能。脂质复合I相互作用及其功能含义的机制仍不清楚:通过合成不同的生物模拟脂质,我们计划在多技术方法中剖析不同脂质与复杂I的相互作用。在这种情况下,PHD项目“单击化学以合成磷脂的合成来研究脂质 - 蛋白与EPR和Cryo-EM方法的相互作用”将着重于研究分子识别机制,从而调节分子识别机制,从而调节伴侣磷脂与天然复合物之间的相互作用。