XiaoMi-AI文件搜索系统
World File Search Systemphost'in Therapeutics和...
PHAST临床试验的协议指导委员会(PSC)一致批准了2024年11月28日的队列扩展阶段。该决定是基于剂量升级阶段的有利的临时结果,该阶段招募了21名患有所有类型的实体瘤患者。2扩展队列将进一步评估推荐的2阶段剂量方案,并在更大,更均匀的患者人群中对治疗的安全性和初步疗效提供更广泛的评估。该试验预计将分别在一系列选定肿瘤中分别注册23例胶质母细胞瘤患者和30例患者,包括浆液性卵巢癌,胃癌和食管癌,肝细胞癌,头颈癌,非小肉类癌症,非小细胞肺癌(NSCLC)和胰腺癌(NSCLC)和胰腺癌。
在治疗晚结直肠癌治疗中的基于Pemetrexed的化学疗法
早期胃食管癌患者可能患有厌食症,消化不良,吞咽困难,腹痛或体重减轻;但是,大约40%的患者仍然无症状,并被诊断出迟到,患有转移性或不可切除的疾病(1,7)。在较早的阶段,通常需要进行多模式治疗,并结合手术和化学疗法,无论有或没有辐射。存在有关如何提供新辅助和佐剂化学疗法的多种策略;但是,没有关于最佳策略的全球共识(8)。除了一些明显的例外,例如食管SCC,手术切除通常仍然需要进行治愈。在转移性或不可切除的疾病的情况下,预后仍然很差,传统的标准护理(SOC)疗法对患者结局的影响有限,中位生存期在四个月之间,最佳支持护理(BSC)(BSC),至十二个月,使用了细胞毒性化学疗法(9,10)。
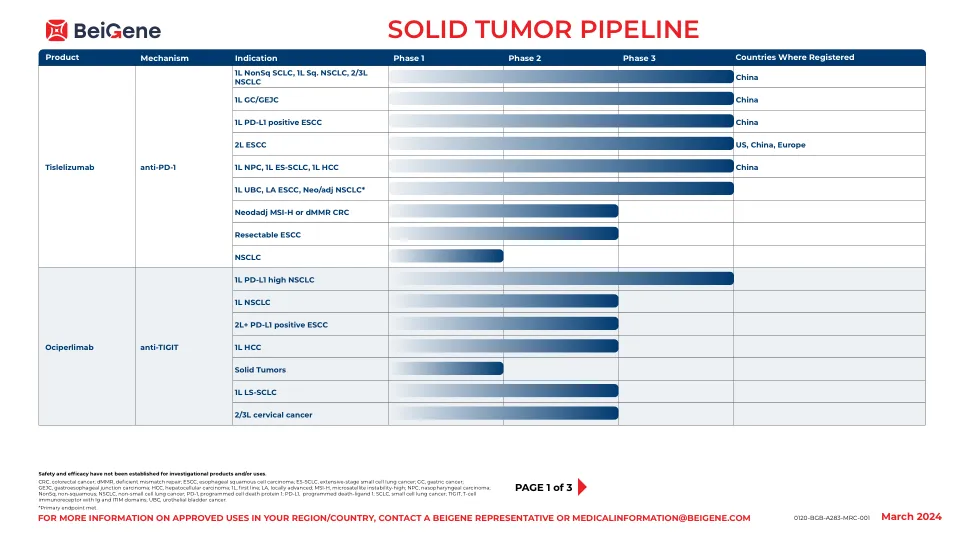
实体瘤管道
TNBC,三阴性乳腺癌; CCR8,CC趋化因子受体8; CD3,分化3群; CRC,结直肠癌; CSF-1R,刺激性因子-1受体; DGKζ,二酰基甘油激酶ζ; DKK1,Dickkopf-1; DLL3,类似三角洲的配体3; ESCC,食管鳞状细胞癌; FGFR,成纤维细胞生长因子受体; GBRCAM,种系BRCA突变; GC-GEJC,胃癌 - 糖食管癌; HCC,肝细胞癌; 1L,第一行; MCRPC,转移性cast割前列腺癌; MTX,维护处理; NSCLC,非小细胞肺癌; PARP,聚(ADP-核糖)聚合酶; PI3KΔ,磷酸肌醇3-激酶三角洲; PSOC,铂敏感的卵巢癌; RAF,快速加速的纤维肉瘤; STEAP1,前列腺1的六跨膜上皮抗原; VEGFR,血管内皮生长因子受体。
特刊 - 遗传学,分子分析和精度...
食管和食管胃癌是最具挑战性的恶性肿瘤之一,发病率高和死亡率。精确药物和生物标志物的使用在增强新辅助和辅助治疗方案方面越来越重要,从而显着提高了患者的生存率。分子分析和精确药物已彻底改变了我们对癌症的理解,并显着增强了患者护理。这种疗法的精确剪裁可以鉴定有针对性的治疗,治疗反应的预测以及将患者分层为临床试验的亚组,从而导致更有效和个性化的癌症管理。本期特刊旨在汇编有关“胃和食管癌中的遗传学,分子分析和精密医学”的广泛论文。通过此汇编,我们试图强调分子分析在这些癌症中的显着进步和应用,从而提高了诊断准确性并促进创新疗法的发展,从而为更好的患者结局。
环状 RNA 在食管鳞状细胞癌临床前体外和体内模型中具有疗效
摘要。食管癌的预后不佳。已获批准的药物主要集中在治疗效果一般的化疗上。最近,检查点抑制单克隆抗体 Pembrolizumab 获批。为了确定治疗食管鳞状细胞癌 (ESCC) 的新靶点和方式,我们在文献中搜索了与 ESCC 发病机制有关的 circRNA。我们确定了两个下调和 17 个上调的 circRNA,以及一个在临床前体内系统中有效的合成 circRNA。下调的 circRNA 吸收针对肿瘤抑制基因的 microRNA。上调的 circRNA 吸收针对 mRNA 的 microRNA,后者编码具有促肿瘤功能的蛋白质。我们讨论了下调 circRNA 的重建和使用短干扰 RNA (siRNA) 相关实体抑制上调 circRNA 等问题。此外,我们还讨论了已确定靶点的药物可行性问题。
癌症
简单总结:食管腺癌 (EAC) 是食管癌的两种主要亚型之一。EAC 是一种致死率极高的疾病,在西方国家发病率不断上升。EAC 与慢性胃食管反流病和巴雷特食管有关,主要发生在远端食管。在过去的几十年里,人们做出了很大的努力来改善治疗策略,包括放化疗、靶向治疗和免疫治疗方案。尽管采用了多模式疗法,但 EAC 患者的生存率仅略有改善,EAC 治疗尚未取得重大突破。我们旨在总结有关 EAC 综合分子景观的文献,以阐明 EAC 恶性行为和不良预后的潜在因素。我们详细讨论了 EAC 的病因、遗传学、表观遗传学和组织学,以及目前采用的治疗方法。从本综述中更好地了解 EAC 的分子生物学可能会为未来开发新疗法提供线索。
NY-ESO-1表位与热休克蛋白70的融合增强了其诱导的免疫反应和对胶质瘤的抗肿瘤活性
纽约食道鳞状细胞癌1(NY-ESO-1)是一种已知的CTA,在许多癌症类型中具有普遍的表达(6,7)。因为它可以引起强大的体液和细胞免疫反应并具有限制的表达模式,所以NY-ESO-1是癌症免疫疗法的有吸引力的候选靶标(8)。最近已经开发了多种结合NY-ESO-1的免疫治疗方法(9-11)。NY-ESO-1疫苗,以治疗表达NY-ESO-1的肿瘤,包括肺癌,食管癌,骨髓瘤(12)和黑色素瘤(6,13)。用树突状细胞(DC) - 靶向整合缺陷型慢病毒载体对肺癌免疫的临床前小鼠模型研究显示出令人鼓舞的结果(14)。然而,只有一小部分的神经胶质瘤表达NY-ESO-1蛋白(15);因此,碱性基于CTA的免疫疗法不适合治疗脑肿瘤。要克服这一局限性并刺激针对神经胶质瘤的强烈免疫反应,我们需要新的CTA诱导策略。
与纤维素合成2D物质的生物传感器技术的进步 - 物理特性
在生物传感器技术中使用二维(2D)材料已革命 - 领域。像石墨烯,过渡金属二核苷(MOS 2和WS 2)这样的材料,六角硼(H-BN)和黑磷具有纳米级厚度和不同的物理特性,可能会大大增强生物传感器的性能[1]。石墨烯具有特殊的电导率和机械强度,以其在生物传感器中的多功能性而广泛认可。其平面结构和高电子迁移率提高了敏感性和特定的特定性,使其成为理想的组成部分[2]。过渡金属二分法源(例如MOS 2和WS 2)由于其分层结构而具有独特的半导管特性。这些材料可以与光线和电场相互作用,使其特别适合需要精确的电特性的生物传感器应用[3]。此外,研究增强了2D材料在癌症生物传感器中的作用:一种用于肺癌检测的MOS 2 /CU 2 O传感器[4],PEC生物传感器的食管癌[5]和用于广泛癌细胞检测的实验室芯片设计[6]。
食管鳞状细胞癌的围手术期免疫疗法
食管鳞状细胞癌(ESCC)是主要的组织学亚型,占全球食管癌病例的85%。传统的ESCC治疗涉及化学疗法,放疗和手术。但是,总体预后仍然不利。最近,使用反编程细胞死亡1(PD-1)/PD-1配体(PD-L1)抗体的免疫检查点阻滞(ICB)治疗不仅在ESCC的临床管理中实现了显着的好处,而且还完全改变了该癌症治疗方法。在短短几年内,ICB治疗已迅速进行,并被添加到ESCC患者的一线治疗方案中。但是,术前免疫疗法尚待批准。在这篇综述中,我们总结了ESCC临床免疫疗法中常用的ICB抗体,并讨论了免疫疗法与化学疗法和放射疗法在ESCC的围手术期治疗中的进展,旨在在整个治疗过程中为ESCC患者的临床管理提供参考。
HGF/c-Met轴:消化系统癌症的进展
消化系统癌症包括肝细胞癌 (HCC)、胃癌、胰腺癌、食管癌和结直肠癌 (CRC),据报道在世界范围内导致高发病率和死亡率(Zhang H. et al., 2018)。人们尝试了许多干预方法,包括手术治疗、化疗、放疗和靶向药物治疗,但它们对消化系统癌症的总体治疗效果仍然不令人满意(Ang et al., 2016)。在晚期发展阶段,基于靶向分子药物和细胞毒性化疗的全身治疗最有希望成功治疗这些癌症。例如,用表皮生长因子受体 (EGFR) 单克隆抗体成功治疗了大鼠肉瘤 (RAS)-野生型 CRC,而使用 HER2 单克隆抗体曲妥珠单抗治疗了人类表皮生长因子受体 2 (HER2) 高表达胃癌( Van Schaeybroeck 等,2011;Gomez-Martín 等,2014)。研究表明,肝细胞生长因子 (HGF)/间质上皮转化 (c-Met) 信号通路在消化系统癌症的生长、侵袭、转移和获得性耐药中起着关键作用。基于这一证据,抑制 HGF/c-Met 轴可能是一种有前途的革命性治疗方法。