XiaoMi-AI文件搜索系统
World File Search System首次人体 1a 期剂量递增研究,BGB-...
BGB-43395(CDK4 选择性抑制剂)单药治疗和与氟维司群或来曲唑联合治疗转移性 HR+/HER2- 乳腺癌和其他晚期实体瘤患者的首次人体 1a 期剂量递增研究 作者:Timothy A. Yap、1 Gerald Falchook、2 Jennifer Man、3 Dhanusha Sabanathan、4 Robert Wesolowski、5 Ildefonso Rodriguez-Rivera、6 Hui Gan、7 Gilbert Y. Wong、8 Yaxi Chen、9 Shiyang Wang、8 Hao Zheng、8 Shom Goel 10 附属机构:1 德克萨斯大学 MD 安德森癌症中心,美国德克萨斯州休斯顿;2 美国科罗拉多州丹佛 Health One 莎拉坎农研究所 (SCRI);3 澳大利亚新南威尔士州布莱克敦布莱克敦癌症和血液学中心; 4 麦考瑞大学,麦考瑞公园,新南威尔士州,澳大利亚;5 詹姆斯癌症医院和索洛夫研究所,美国俄亥俄州哥伦布市;6 NEXT 肿瘤科,美国德克萨斯州圣安东尼奥市;7 奥斯汀医院,海德堡,维多利亚州,澳大利亚;8 百济神州美国公司,美国加利福尼亚州圣马特奥市;9 临床开发,百济神州(北京)有限公司,中国北京;10 彼得麦卡勒姆癌症中心,澳大利亚维多利亚州墨尔本 摘要背景:尽管细胞周期依赖性激酶 (CDK) 4/6 抑制剂 (CDK4/6i) 已获准用于治疗 HR+/HER2- 乳腺癌 (BC),但患者在接受当前治疗时可能会产生耐药性和毒性。 BGB-43395 是一种强效且选择性强的 CDK4i,表现出临床前抗肿瘤活性,CDK4 覆盖率更高,对 CDK4 的选择性高于 CDK6,从而最大限度地减少了脱靶毒性和潜在毒性相关的剂量减少/停药。我们在此介绍正在进行的首次人体 1a 期剂量递增、开放标签、多中心试验的初步结果,该试验对 BGB-43395 进行了单药口服治疗,用于晚期实体瘤患者(A 部分),或作为联合治疗的一部分,用于 2L+ HR+/HER2- BC 患者(NCT06120283)。方法:符合条件的患者年龄≥18 岁,经组织学或细胞学证实患有与 CDK4 依赖性相关的晚期、转移性或不可切除的实体瘤。允许的既往治疗包括:对于 HR+/HER2- BC 患者,在辅助治疗或晚期转移性治疗中接受 ≥2 线治疗,包括内分泌治疗 (ET) 和 CDK4/6i;对于 HR+/HER2+ BC 患者,接受 ≥2 线 HER2 靶向治疗;对于其他晚期实体瘤患者,接受标准治疗。主要目标是评估 BGB-43395 作为单一疗法或与氟维司群或来曲唑联合治疗的安全性和耐受性,并确定最大耐受剂量或最大给药剂量以及推荐的扩增剂量。次要终点是评估研究者根据 RECIST v1.1 评估的药代动力学和初步抗肿瘤活性。结果:截至 2024 年 5 月 20 日,共有 23 名患者(A 部分 17 名 [包括 6 名 HR+/HER2- BC]、B 部分 3 名、C 部分 3 名)参加了该研究的持续剂量递增部分。总共有 7 个剂量组(A 部分 5 名,B 部分 1 例,C 部分 1 例)。在 A、B 和 C 部分中,分别有 14/17 (82.4%)、2/3 (66.7%) 和 3/3 (100%) 例患者患有转移性疾病。A 部分所有患者既往治疗线数中位数(范围)为 3.0 (1-10)(A 部分 6 名 HR+/HER2- 患者为 3.5 [2-10]),B 部分为 4.0 (2-8),C 部分为 4.0 (1-5)。A、B 和 C 部分中的 12 名 HR+/HER2- BC 患者均接受过 CDK4/6i、ET 和化疗 (CT),C 部分中有 1 名患者未接受 CT。 TEAE 发生在 A、B 和 C 部分中分别有 15/17 (88.2%)、1/3 (33.3%) 和 0 名患者,主要为 1 级和 2 级。对于所有 23 名患者,最常见的 TEAE 是腹泻(12/23;52.2%;1 名患者 3 级)、恶心(7/23;30.4%;所有 1 级和 2 级)、贫血(3/23;13.0%;1 名患者 3 级)、疲劳(3/23;13.0%;所有 1 级和 2 级)和呕吐(3/23;13.0%;所有 1 级和 2 级)。 23 名患者中 14 名 (60.9%) 发生了治疗相关不良反应(A 部分 13 名、B 部分 1 名、C 部分 0 名),主要为 1 级和 2 级,但
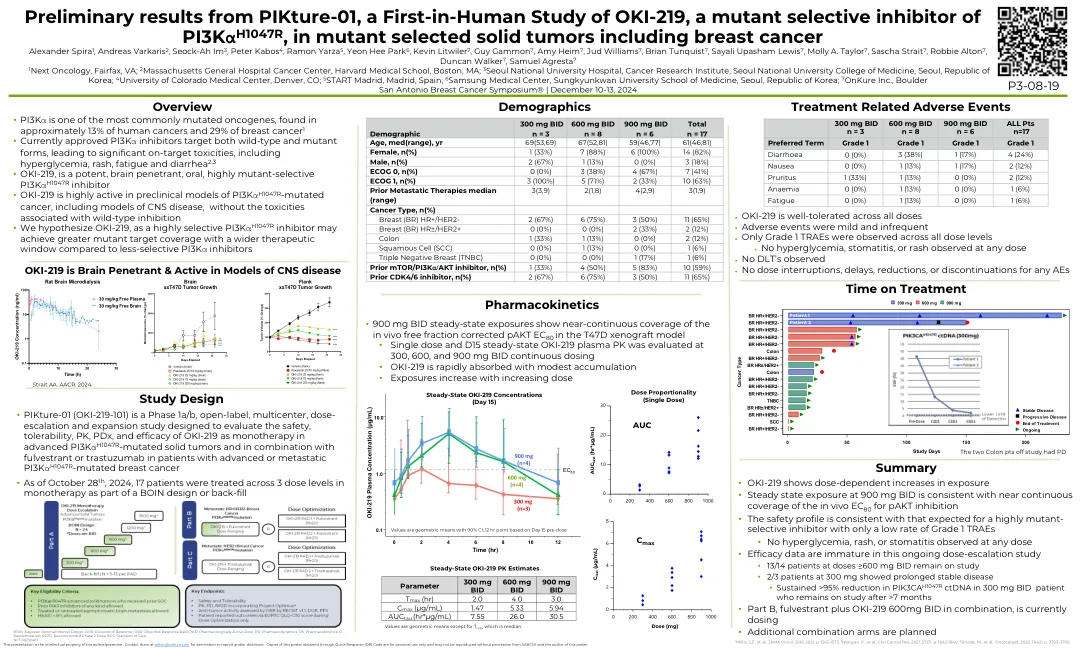
PIKture-01 的初步结果,这是一项针对 OKI-219(PI3K α H1047R 突变选择性抑制剂)的首次人体研究,用于治疗突变型选定实体瘤
概述 • PI3K α 是最常见的突变致癌基因之一,在约 13% 的人类癌症和 29% 的乳腺癌中发现 1 • 目前批准的 PI3K α 抑制剂靶向野生型和突变型,导致显著的靶向毒性,包括高血糖、皮疹、疲劳和腹泻 2,3 • OKI-219 是一种强效、脑渗透性、口服、高度突变选择性 PI3K α H1047R 抑制剂 • OKI-219 在 PI3K α H1047R 突变癌症的临床前模型(包括中枢神经系统疾病模型)中具有高度活性,但没有与野生型抑制相关的毒性 • 我们假设 OKI-219 作为一种高度选择性 PI3K α H1047R 抑制剂,与选择性较低的 PI3K α 抑制剂相比,可以实现更大的突变靶标覆盖率和更宽的治疗窗口
精确健康与医学的首次混合研讨会
15:00-17:00(CET)上午9:00-11:00 AM(EST)糖尿病中心Bern McGill基因组建筑站点室6001房间6001房间04.211(“循环”)740 Penfield Avenue Avenue Freiburgstrasse 3,BernMontréal
首次癫痫发作揭示了晚期发病的Fahr病
fahr病(FD),也称为原发性家族性脑钙化,是一种罕见的神经退行性疾病,涉及基底神经节和其他大脑区域水平的脑钙化。它是一种遗传性神经疾病,尽管尚未彻底定义其分子遗传学。患者通常出现多种症状,主要是运动障碍和认知变化。但是,癫痫发作是成年人晚期FD的罕见初始呈现特征。在此,我们介绍了一名60岁男子,没有已知的慢性疾病,该男子在经历了首次概括性强调癫痫发作和两天的意识丧失后被送往三级医院。基本实验室结果在正常范围内,非对比度脑计算机断层扫描(CT)扫描显示出脑钙化。该患者根据其修饰的诊断标准被诊断为继发于FD的癫痫病,并对抗癫痫治疗的反应良好。该案例强调了一种罕见的关联,并强调了考虑首届癫痫发作的患者的诊断的重要性;应进行适当的测试以确认或排除其他相关和次要原因,并应相应地修改治疗。
首次签署了Braintransporter技术协议-Bioarctic
•本演示文稿包括前瞻性语句。这些前瞻性陈述涉及已知和未知的风险,不确定性和其他因素,这可能会导致生物二氧化碳的实际结果,绩效,成就或行业结果与这些前瞻性陈述所表达或暗示的陈述实质上不同。前瞻性陈述仅在本演讲之日起说明,而生物敏捷的陈述明确违反了本演示文稿中对任何前瞻性陈述的任何更新或修订的任何义务或承诺,这是由于生物极点期望的任何变化或这些前瞻性陈述所基于的事件,条件或情况的任何变化而导致的。
正在进行的试验:BGB-43395(CDK4 选择性抑制剂)作为单一疗法或联合疗法的首次人体 1a/1b 期剂量递增/扩展研究
1L,一线;2L,二线;BID,每日两次;CBR,临床受益率;CT,化疗;DCR,疾病控制率;DOR,缓解持续时间;ECOG PS,东部肿瘤协作组体能状态;ET,内分泌治疗;GnRH,促性腺激素释放激素;HER2,人表皮生长因子-2;HR,激素受体;MAD,最大给药剂量;MTD,最大耐受剂量;mTPI-2,改良毒性概率区间-2;ORR,客观缓解率;OS,总生存期;PFS,无进展生存期;PK,药代动力学;QD,每日一次;RDFE,扩展推荐剂量;RECIST,实体肿瘤疗效评价标准;SOC,标准治疗;TTR,缓解时间。
生物多样性报告 - 首次考虑 - 布伦特伍德委员会
i。应对《环境计划》第2021号法案对地方规划部门施加的新公司生物多样性义务,要求地方规划部门在生物多样性报告中提出和报告有关生物多样性行动的行动。II。 交付和监控生物多样性净收益(BNG)是2024年1月生效的新开发的强制性要求,必须构成生物多样性报告的一部分。 1.2政府在2018年发布了25年的环境计划,表明他们将加强生物多样性的义务,并引入强制性的生物多样性净收益制度(即 确保与开发相关的野生动植物的栖息地比开发的状态更好。 1.3 2023年1月出版的环境改进计划(EIP23)建立在25年成立的基础上,并通过与土地所有者,社区和企业合作朝着融合的愿景来制定了政府计划,以显着改善自然环境。 1.4《环境法》 2021年于2021年11月9日获得皇家同意,并修改了《 2006年自然环境和农村社区法》第40条(保存生物多样性的义务),因此现在有一个一般的生物多样性目标,它是“保护和增强生物多样性的保护和增强”。 要遵守义务计划部门,必须考虑当局可以采取的行动“进一步促进一般的生物多样性目标”。 1.6政府最初建议10%的生物多样性净收益(BNG)将于2023年11月成为所有主要发展。II。交付和监控生物多样性净收益(BNG)是2024年1月生效的新开发的强制性要求,必须构成生物多样性报告的一部分。1.2政府在2018年发布了25年的环境计划,表明他们将加强生物多样性的义务,并引入强制性的生物多样性净收益制度(即确保与开发相关的野生动植物的栖息地比开发的状态更好。1.3 2023年1月出版的环境改进计划(EIP23)建立在25年成立的基础上,并通过与土地所有者,社区和企业合作朝着融合的愿景来制定了政府计划,以显着改善自然环境。1.4《环境法》 2021年于2021年11月9日获得皇家同意,并修改了《 2006年自然环境和农村社区法》第40条(保存生物多样性的义务),因此现在有一个一般的生物多样性目标,它是“保护和增强生物多样性的保护和增强”。要遵守义务计划部门,必须考虑当局可以采取的行动“进一步促进一般的生物多样性目标”。1.6政府最初建议10%的生物多样性净收益(BNG)将于2023年11月成为所有主要发展。1.5规划机构对这些行动的考虑,行动和报告是《环境法》要求的,要在生物多样性报告中列出,以及立法和随附的指导列出了报告的时间表和所需内容,其中包括有关生物多样性净收益的报告。11月的日期随后被推回2024年1月,仅适用于BNG的主要开发项目,最终为2024年4月的其他相关发展生效。
精准心脏病学:变革遗传性心肌病治疗并首次展望下一代创新
我们提醒读者,本演示文稿包含涉及重大风险和不确定性的前瞻性陈述。本演示文稿中除历史事实陈述之外的所有陈述均为前瞻性陈述。前瞻性陈述包括但不限于有关以下内容的陈述:我们的 AOC 技术开发精准心脏病疗法的能力;AOC 1086 针对 PLN 心肌病的能力、AOC 1072 针对 PRKAG2 综合征的能力以及我们针对其他遗传性心脏病的能力;我们将 siRNA 输送到心脏的能力;我们临床前产品候选药物的 IND 途径;我们的产品候选药物在心脏病中改变病情的潜力;我们的商业战略;我们产品候选药物的安全性和耐受性概况,包括我们精准心脏病产品候选药物的临床前非人体研究;AOC 1086 和 AOC 1072 的设计和能力;AOC 1086 和 AOC 1072 的有效性;我们的下一代技术及其潜在影响;我们下一代技术带来的交付和耐用性的提高;我们下一代技术的设计和能力;成功的时机和可能性;产品批准;以及管理层对未来运营的计划和目标。在某些情况下,读者可以通过“可能”、“将”、“应该”、“预期”、“计划”、“预期”、“可以”、“打算”、“目标”、“项目”、“考虑”、“相信”、“估计”、“预测”、“潜在”或“持续”等术语或这些术语的否定词或其他类似表达来识别前瞻性陈述。前瞻性陈述的纳入不应被视为 Avidity 表示我们的任何计划都会实现。由于我们业务中固有的风险和不确定性,实际结果可能与本演示文稿中的结果不同,这些风险和不确定性基于我们无法控制的因素,包括但不限于:与 AOC 1086 和 AOC 1072 相关的临床前数据可能不支持 IND 申请或批准;临床前研究和早期临床试验的结果不一定能预测未来的结果;我们的技术在心脏疾病方面的应用范围可能有限;我们的下一代技术尚未得到证实,并且可能不会提供超出我们现有技术的任何功能;与我们的产品候选物和技术相关的其他非人类灵长类动物和小鼠数据可能会继续与截至本文发布之日产生的数据不一致,对现有数据的进一步分析和对新数据的分析可能会导致与截至本文发布之日得出的结论不同的结论;我们的产品候选物的意外不良副作用或疗效不足可能会延迟或限制其开发、监管部门批准和/或商业化,或可能导致临床试验暂停,召回或产品责任索赔;我们的开发工作尚处于早期阶段;我们基于 AOC 平台发现和开发候选产品的方法尚未得到证实,我们不知道是否能够开发出任何具有商业价值的产品;临床试验的开始、登记和完成,或监管机构授予的指定可能会延迟;我们在临床前和临床测试以及产品制造方面对第三方的依赖;我们可能无法实现与第三方合作的预期收益,我们现有的合作可能比预期提前终止,或者我们可能无法建立新的合作;美国和外国的监管发展,包括接受 IND 和类似的外国监管提交以及我们拟议的未来临床试验设计;FDA 批准 IND 申请可能不会导致临床试验成功或产品批准;我们获得和维持候选产品和专有技术的知识产权保护的能力;同样针对心脏病和我们所针对的其他疾病的竞争对手可能在资源、技术或其他优势方面胜过我们;我们可能会比预期更快地耗尽我们的资本资源,并且无法筹集到所需的额外资金;以及我们于 2024 年 2 月 28 日向 SEC 提交的截至 2023 年 12 月 31 日的年度 10-K 表格中“风险因素”标题下所述的其他风险,该表格以及随后向 SEC 提交的文件中均是如此。请读者不要过分依赖这些前瞻性陈述,这些陈述仅代表截至本文发布之日的观点。除适用法律要求外,我们不打算公开更新或修改本文包含的任何前瞻性陈述,无论是由于任何新信息、未来事件、情况变化还是其他原因。所有前瞻性陈述均受本警告声明的全部约束,该声明根据《1995 年私人证券诉讼改革法》的安全港条款作出。包括接受 IND 和类似的外国监管提交以及我们未来临床试验的拟议设计;FDA 批准 IND 申请可能不会导致临床试验成功或产品获批;我们获得和维护产品候选物和专有技术的知识产权保护的能力;同样针对心脏病和我们针对的其他疾病的竞争对手可能在资源、技术或其他优势方面胜过我们;我们可能会比预期更快地耗尽资本资源,并且无法筹集到所需的额外资金;以及我们于 2024 年 2 月 28 日向美国证券交易委员会提交的截至 2023 年 12 月 31 日的 10-K 表格以及随后向美国证券交易委员会提交的文件中“风险因素”标题下所述的其他风险。请读者不要过分依赖这些前瞻性陈述,这些陈述仅在本文发布之日有效。除适用法律要求外,我们不打算公开更新或修改本文中包含的任何前瞻性陈述,无论是由于任何新信息、未来事件、情况变化还是其他原因。所有前瞻性陈述均完全符合本警告声明的规定,该声明是根据 1995 年私人证券诉讼改革法的安全港条款作出的。包括接受 IND 和类似的外国监管提交以及我们未来临床试验的拟议设计;FDA 批准 IND 申请可能不会导致临床试验成功或产品获批;我们获得和维护产品候选物和专有技术的知识产权保护的能力;同样针对心脏病和我们针对的其他疾病的竞争对手可能在资源、技术或其他优势方面胜过我们;我们可能会比预期更快地耗尽资本资源,并且无法筹集到所需的额外资金;以及我们于 2024 年 2 月 28 日向美国证券交易委员会提交的截至 2023 年 12 月 31 日的 10-K 表格以及随后向美国证券交易委员会提交的文件中“风险因素”标题下所述的其他风险。请读者不要过分依赖这些前瞻性陈述,这些陈述仅在本文发布之日有效。除适用法律要求外,我们不打算公开更新或修改本文中包含的任何前瞻性陈述,无论是由于任何新信息、未来事件、情况变化还是其他原因。所有前瞻性陈述均完全符合本警告声明的规定,该声明是根据 1995 年私人证券诉讼改革法的安全港条款作出的。
首次参与远程医疗综合体重管理试点项目 Laura B. Langston, MHA a , Ryan R. Lau, MS, R.EEG/EP T., CNIM, CLTM, FASET
改编自华盛顿大学 AIMS 中心创作的作品,2023 年 10 月 18 日,http://aims.uw.edu/collaborative-care/team-structure 华盛顿大学 AIMS 中心,2022 年 2 月 22 日访问,http://aims.uw.edu/collaborative-care Shrader,S.,等人(2013 年)。“跨专业团队合作技能作为模拟医疗环境中临床结果的预测指标。” J Allied Health 42(1) SC 在线人口健康仪表板揭示社区差异,2016 年 9 月 19 日,https://healthitanalytics.com/news/sc-online-population- health-dashboard-reveals-community-disparities 南卡罗来纳州营养、身体活动和肥胖概况,2023 年 10 月 19 日访问,https://www.cdc.gov/nccdphp/dnpao/state-local-programs/profiles/pdfs/south-carolina-state-profile.pdf