XiaoMi-AI文件搜索系统
World File Search System可持续海洋经济高级别小组年度领导人会议,纽约,2024 年 9 月 25 日 联合国大会高级别周大使致辞
可持续海洋经济高级别小组年度领导人会议,纽约,2024 年 9 月 25 日 联大高级别周 彼得·汤姆森大使代表联合国秘书长发表的讲话 各位阁下, 感谢大家给我这个机会,让我今天上午代表联合国秘书长向大家致辞。 我谨就第二份海洋小组进展报告中所取得的成就向你们表示祝贺。 众所周知,海洋小组的 14 个创始成员承诺在明年年底前制定可持续海洋计划,到目前为止,9 个小组成员已经实施或正在相应更新他们的计划。 这是非常重要的进展,我赞扬所有参与其中的人。 海洋只有一个,一切都是相连的。因此,你们今天启动的“100%可持续海洋管理联盟”无疑将产生全球影响,因为它将鼓励每个沿海和海洋国家加入到到 2030 年实现 100% 可持续海洋管理的承诺中。我感谢法国和世界资源研究所对这一宝贵倡议的领导。各位阁下,第三届联合国海洋大会将于明年 6 月在尼斯举行,会议即将召开。会议共同主办国哥斯达黎加和法国正在与联合国大家庭的相关代表密切合作,确保这次支持可持续发展目标 14 的全球会议能够实现联合国会员国要求的成果。会议十个海洋行动小组的主题现在已经公布,我鼓励海洋小组成员自愿担任共同主席。作为公认的海洋福祉领导者,我非常希望贵国代表明年抵达尼斯时,能够通过实现出色的多边海洋措施为其他国家树立榜样。这些措施包括尽早批准《BBNJ协定》,以及在世界贸易组织采取协调一致的国际行动,终止有害的渔业补贴。与此同时,我们应该
加速绿色能源前景融资行动与伙伴关系高级别小组
会议描述 COP 29 主席国将在今年的 COP 上发起巴库气候融资、投资和贸易倡议 (BICFIT),并于 11 月 14 日正式启动。BICFIT 将是一个多利益相关方倡议,其中包括政府、发展机构、多边开发银行、气候基金和私营部门。其目的是加强气候融资、投资和贸易,特别强调实现符合联合国可持续发展目标 (SDG) 和公正转型原则的社会经济协同效益。它既提议充当信息和最佳实践交流的论坛,也提议建立行动导向的伙伴关系。其中包括可以为 NDC 实施提供融资、投资和贸易支持的机制。小组提议解决 BICFIT 寻求解决的挑战的核心问题之一,即如何加速绿色能源项目的融资,以支持公正和公平的能源转型,以及如何解决适应和减缓的关键全球资金需求。它将寻求确定现有的障碍(限制融资和阻碍绿色项目的问题,特别是在发展中国家),以及确定可以实施、扩大和快速推进的现实和实用的干预措施。关于障碍,小组将探讨新兴经济体资本成本的特殊挑战(即使是太阳能光伏等成熟技术,其平均成本也至少是经合组织平均水平的两倍)。它还将考虑这些经济体如何建立吸引大规模投资的能力的问题。为了找到解决方案,小组将考虑大规模调动投资的潜在机制的优点和可行性。拟定发言人和主持人主持人:
在SCQF级别7
本单元使学习者能够对支持儿童和年轻人的游戏,学习和发展的教学方法发展了解。学习者探讨儿童发展的原则,并评估理论方法对了解儿童发展的贡献。他们运用实践与理论之间的联系。您应该教学习者认识到每个孩子的独特性以及满足其个人需求和利益的重要性。此外,您应该教他们生活经验和家庭活动如何影响儿童和年轻人的发展,福祉和韧性。学习者研究了观察的使用在支持儿童和年轻人的游戏,学习和发展,并发展他们的技能,以批判性地反思实践。他们对课程和当前指导如何帮助儿童练习环境中的儿童和年轻人有所帮助。了解游戏在支持儿童和年轻人的发展,福祉和韧性方面的价值至关重要。学习者比较相关的教学理论。他们探索了在室内和室外的刺激性和包容性游戏环境的创造,并研究从业人员在支持此环境中的作用。学习者通过反思他们采用的教学方法来结束单位。进入该单位的酌处权是由您的中心自行决定的,但是,我们建议学习者在SCQF 6级和/或在儿童实践部门工作的经验具有相关资格。作为高等国家证书(HNC)童年练习的一部分完成此部门的学习者可能有机会进一步学习,包括高级国家文凭(HND)或学位水平课程。
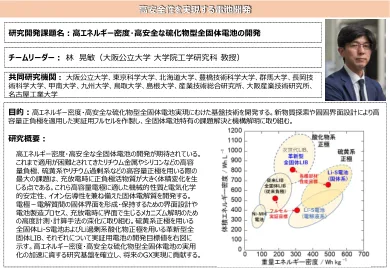
实现高安全性的电池开发
预计将开发具有高能量密度和高安全性的全稳态电池(ASSB)。使用高容量负电极(例如锂金属和硅)以及高容量的正极电极(例如基于硫基于硫的氧化物和富含Li的氧化物材料)的主要挑战是,正和负电极的活性材料在充电和排放期间经历较大的体积变化。在该项目中,将开发适合这些高容量电极的机械性能,电化学稳定性和离子电导率的固体电解质。我们还专注于界面设计,以形成和维护电极和电解质,电池制造过程之间的固体界面以及高级分析和计算方法,以阐明循环过程中界面处发生的机制。该图显示了使用基于硫的阳性电极和晚期阳性液体使用富含Li的氧化物阳性电极的发育目标。我们将建立基本技术,以加速具有高能量密度和高安全性的Assb的商业化,并在将来实现GX。
人工智能与经济金融政策制定 高级别专家组向七国集团提交的报告
执行摘要 1 引言 5 1. 不确定性下的政策制定:关于人工智能的未解问题 9 1.1. 人工智能的非线性出现 9 1.2. 技术问题 11 1.3. 市场结构的不确定性:竞争还是市场集中? 16 1.4. 人工智能人才缺口 20 1.5. 人工智能为谁而生?传播的挑战 21 1.6. 一把双刃剑?人工智能与环境可持续性 23 2. 人工智能的宏观经济影响 26 2.1. 人工智能时代的衡量挑战 26 2.2. 创新与增长 27 2.3. 就业和劳动生产率 33 2.4. 分配效应 37 3. 金融机构和当局对人工智能的使用 39 3.1. 税收设计和征收 39 3.2. 支出有效性和效率 41 3.3. 金融机构和当局的工作未来 44 3.4.最大限度地减少人工智能在政府金融职能中的碳足迹 46 3.5. 政府采用人工智能的障碍 47 3.6. 人工智能驱动的政府职能中的网络安全挑战 49 4. 人工智能与金融稳定 51 4.1. 系统性风险 52 4.2. 不透明度和金融监管 55 4.3. 金融部门的网络安全 56 4.4. 真正的颠覆和财务影响 56 5. 政策建议 58 5.1. 人工智能情景 59 5.2. 人工智能情景:对经济和金融系统的影响 61 5.3. 经济和金融政策中人工智能政策准备的即时建议 62 5.4. 人工智能政策准备矩阵 67 缩略语列表 71 参考文献 72 附件 84