XiaoMi-AI文件搜索系统
World File Search System胰腺癌 RAF 家族变异的回顾性病例系列分析:靶向治疗和标准治疗的真实结果
结果 在从大型分子数据库得出的患病率队列中,PC 中 RAF 变异的发生率为 2.2%(3,781 人中的 84 人),其中 BRAF V600E(外显子 15)、BRAF Δ NVTAP(外显子 11)和 SND1-BRAF 融合是最常见的变异。在我们的回顾性病例系列中,我们发现 81 个分子谱中有 17 个(21.0%)存在 BRAF V600/外显子 15 突变而无任何混杂驱动因素,81 个分子谱中有 25 个(30.9%)存在 BRAF 或 RAF1 融合,81 个分子谱中有 18 个(22.2%)存在外显子 11 突变。81 个分子谱中其余 21 个(25.9%)存在非典型 RAF 变异和/或多个致癌驱动因素。在 V600 亚组中,有 3 例受试者(2 例部分缓解)、6 例融合患者(2 例部分缓解)、6 例外显子 11 突变患者(2 例部分缓解)和 3 例混杂驱动因素患者中,有 0 例观察到 BRAF/MEK/ERK 抑制剂的临床益处。结果分析还表明,在融合亚组中,氟尿嘧啶类方案优于吉西他滨/白蛋白结合型紫杉醇(P = .027)。
非小细胞肺癌(NSCLC)中EGFR外显子7突变的新发现:四个病例的临床和病理分析
表皮生长因子受体(EGFR)基因的18至21的外显子基因是NSCLC患者中最常见的突变区域[1]。在具有特定EGFR突变的NSCLC患者中,对酪氨酸激酶抑制剂(TKI)的治疗有良好的反应,例如19-DEL,L858R,T790M,20-INS,G719X,S768I和L861Q [2]。近年来,临床实践中大规模平行测序技术的开发和标准化实施使得可以鉴定稀有突变,包括EGFR的外显子7中的突变。2018年,Dai L等。 [3]报道了C.866C> t(p。A289V)突变,它影响了EGFR外显子7的细胞外区域。 该突变尚未包含在主要国际数据库中,例如Oncokb,Uncormon EGFR和Clinvar [4]。2018年,Dai L等。[3]报道了C.866C> t(p。A289V)突变,它影响了EGFR外显子7的细胞外区域。该突变尚未包含在主要国际数据库中,例如Oncokb,Uncormon EGFR和Clinvar [4]。
激肽释放酶基因家族变异和过度活动型埃勒斯-丹洛斯综合征
覆盖度在外显子组测序中达到最高,从27.7X到33.6X不等。外显子组的中位覆盖度从14X到100X不等,而基因组测序则从27X到33X不等。从受试者的覆盖度来看,对于外显子组测序,超过58.8%的受试者对所有变异的覆盖度超过10X,对于许多变异,这个值达到了100%。对于15X和20X的覆盖度也是如此,拥有这种覆盖度的受试者比例最低分别为49.9%和35.7%,在很多情况下,这个值达到了100%。对于基因组测序,超过99.1%的受试者对所有变异的覆盖度超过10X,对于许多变异,这个值达到了100%。 15X 和 20X 以上的覆盖率也是如此,具有此类覆盖率的受试者的最低比例分别为 96.0% 和 82.9%,在许多情况下,该值达到 99.3% 和 95.1%。这些来自外显子组和基因组测序的覆盖率统计数据确保了变异调用的高可信度,并强调了我们
腺嘌呤碱基编辑介导的外显子跳跃在培养猪细胞中诱导基因敲除
在存在原间隔区相邻基序 (PAM) 序列的情况下,ABE 可用于将猪基因组中特定位置的 A·T 转换为 G·C,从而模拟单碱基突变引起的遗传疾病(Anzalone 等人,2020 年;Porto 等人,2020 年)。然而,基因敲除需要将起始密码子 ATG 转换为 GTG(或将 ATG 转换为
在突变小鼠品系中,基因通过跳过外显子重新启动转录和翻译,从而超越基因靶向策略
小鼠胚胎干细胞或受精卵中的基因破坏是鉴定体内基因功能的传统遗传学方法。然而,由于不同的基因破坏策略使用不同的机制来破坏基因,这些策略可能导致所得小鼠模型出现不同的表型。为了确定不同的基因破坏策略是否会影响所得突变小鼠的表型,我们对通过三种常用策略(确定性敲除 (KO) 优先和 CRISPR/Cas9)产生的 Rhbdf1 小鼠突变株进行了表征。我们发现 Rhbdf1 对不同的 KO 策略的反应不同,例如,通过跳过外显子并重新启动翻译来潜在地产生获得功能的等位基因,而不是预期的无效或严重的次等位基因。我们的分析还显示,使用 KO 优先策略产生的小鼠中至少有 4% 表现出相互冲突的表型,这表明外显子跳过是整个基因组中普遍存在的现象。此外,我们的研究强调,至少 35% 的小鼠和 45% 的人类蛋白质编码基因可能易于发生靶向 KO 优先和 CRISPR/Cas9 介导的意外翻译。我们的研究结果对基因组编辑在基础研究和临床实践中的应用具有重要意义。简介小鼠在基因上与人类密切相关,因此选择小鼠作为模型系统来破译约 20,000 个蛋白质编码基因的功能,以深入了解人类生物学和疾病。对于大规模小鼠诱变工作,通过小鼠胚胎干 (ES) 细胞中的同源重组进行基因靶向是一种有效且通用的技术。基因靶向涉及确定性无效设计(删除目标基因的整个基因组序列)或靶向敲除 (KO) 优先设计,这提供了多种优势,包括基因破坏和报告标记突变,此外,还允许以组织特异性或时间方式分析基因功能。最近,使用 CRISPR/Cas9 直接破坏受精卵中的基因已经取代了确定性无效和 KO-first 策略。为了确定不同的基因靶向策略是否会影响纯合突变小鼠的表型,我们系统地表征了由这三种 KO 策略(确定性无效、靶向 KO-first 和 CRISPR/Cas9)产生的 Rhbdf1 突变小鼠。Rhbdf1 基因编码 RHBDF1,并被认为在生长发育 [1]、炎症 [2] 和癌症 [3-5] 中起关键作用。确定性无效和靶向 KO-first 策略是强大的高通量方法,可用于 ES 细胞中的大规模基因靶向,以研究数千种哺乳动物蛋白质编码基因,从而更好地了解人类生物学和疾病 [6-8]。在使用确定性无效策略时,基于细菌人工染色体 (BAC) 的打靶载体替换靶基因的整个基因组序列 (补充图 1a),从而产生无效等位基因。相比之下,靶向 KO-first 方法 [9, 10] 是一种包括可根据所需结果选择的替代步骤的策略,具有高度的通用性,
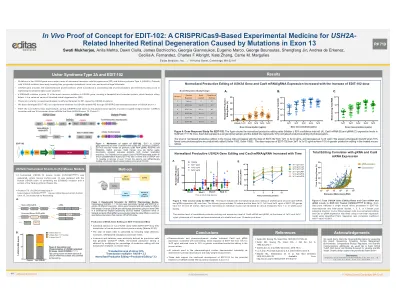
Mukherjee_ASGCT USH2A 海报_最终版
图 1:EDIT-102 的作用机制。*USH2A 基因中的 Ex13 代表导致 IRD 的任何外显子 13 突变,包括 c.2299delG。EDIT-102 编码人类 U6 启动子、向导 RNA(gRNA;RSQ9145 和 RSQ9265)、hGRK1 启动子、SV40(猿猴病毒 40)SD/SA(剪接供体/剪接受体)序列元素、NLS(核定位序列)、Sa(金黄色葡萄球菌)Cas9(CRISPR 相关蛋白 9)和 pA(多聚腺苷酸化信号)。EDIT-102 在 USH2A 外显子 13 的两侧进行编辑,导致外显子 13 从基因组和 mRNA 中去除,从而产生缺乏氨基酸 723-936 的功能性 Usherin 蛋白。
4467例NSCLC患者EGFR突变NGS与ARMS-PCR综合分析
摘要 背景 通过比较扩增阻滞突变系统PCR(ARMS-PCR)与二代测序(NGS)对非小细胞肺癌(NSCLC)靶基因突变的检出率及类型,阐述非小细胞肺癌检测的特点和应用优势,为临床医生有效选择相应检测方法提供依据。方法与材料 选取重庆医科大学附属第一医院2016年1月至2020年10月肺癌靶基因病例,共纳入样本4467例,经病理活检确诊为NSCLC。样本来源包括手术切除、支气管镜活检、转移性活检、血液、痰液、胸腔积液细胞学检查。其中ARMS-PCR技术检测3665例,NGS技术检测802例。比较不同NSCLC样本中ARMS-PCR与NGS技术对EGFR基因突变(包括外显子18、外显子19、外显子20、外显子21等)的检出率及突变类型。结果ARMS-PCR检测出的EGFR基因总突变率为47.6%,NGS检测出的EGFR基因总突变率为42.4%,两种方法对EGFR基因总突变检测结果存在显著差异(P<0.001)。在不同外显子上,两种方法检测到的EGFR突变率不同,ARMS-PCR检测的外显子19的突变率明显高于NGS检测,而外显子20和21的突变率均明显低于NGS检测,且NGS检测出的多重突变率为16.3%,高于ARMS-PCR检测出的2.7%,具有统计学差异。结论NGS技术对耐药患者用药具有指导作用,但NGS技术虽然可以检测出一些罕见位点,但其重要性和指导意义尚不明确,且罕见突变数量较少,尚需进一步研究新的生物标志物和技术,以期早期诊断、指导用药、评估治疗预后。
细胞和基因治疗
治疗至少 4 岁的杜氏肌营养不良症患者 Elevidys 是一种腺相关病毒基因疗法,最初于 2023 年 6 月获批用于治疗 DMD 基因确诊突变的 4 至 5 岁门诊 DMD 儿科患者。该适应症获得加速批准,基于在接受 Elevidys 治疗的患者中观察到的 Elevidys 微肌营养不良蛋白的表达,继续批准取决于确认性试验。Elevidys 禁用于 DMD 基因外显子 8 和/或外显子 9 存在任何缺失的患者。2024 年 6 月,FDA 批准扩大 Elevidys 的标签适应症,将 DMD 基因确诊突变且年龄至少 4 岁的 DMD 患者纳入其中。为确认功能益处,FDA 批准了对门诊患者的传统批准。FDA 批准了对非门诊患者的加速批准。是否继续批准用于非卧床性 DMD 患者可能取决于在确认性试验中对临床益处的验证。Elevidys 仍禁用于 DMD 基因外显子 8 和/或外显子 9 存在缺失的患者。
分子和细胞上下文影响SCN8A变异函数
引入编码电压门控钠(Na V)通道的基因中的致病变异在患有早发作,发育和癫痫性脑病(DEE)的个体中经常发现,以及相关的神经发育障碍(NDDS)(NDDS)(1,2)。确定Na V通道变体的功能后果可以提供有关病理生理机制的信息,并可能指导精确的治疗方法(3,4)。使用正确的分子环境(例如,物种起源,剪接同工型)来研究离子通道变体的功能,对于准确的评估至关重要。编码Na V 1.6的SCN8A中的致病变异已成为神经衰变疾病的重要原因,在婴儿期间典型发作(5)。最早发现的DEE与具有功能获得性能的非截断变体(例如增强的持续电流,激活的电压依赖性改变)。随后,在患有临床严重程度较大的表情的个体中发现了SCN8A变体,而没有癫痫发作(6)。在成熟的神经元中,Na V 1.6位于轴突初始段,该通道用于发起动作电位(7)。基因在早期发育过程中经历了特定的替代剪接事件,包括框架内包含2个不同版本的外显子5中的1个,该版本编码了第一个电压 - 感应域的一部分(8)。重要的是,国家生物技术信息中心(NCBI)指定为变体1(NM_014191)的SCN8A参考编码顺序(NM_014191)包括外显子5N,而包括外显子5A的序列为外显子5N在胚胎发育期间和出生后立即占主导地位,但大约1岁的转录本包含替代外显子5A超过含有5N的外显子,并且5A同工型在春季春季占主导地位(9)。
勘误表:高效基因编辑策略......
图 1 | 葡聚糖水二激酶 (GWD) 1 — gRNA 靶区的结构和完整等位基因序列。上图为外显子(方框)和包含碳水化合物结合模块 (CBM) 的区域的整体基因结构。左图:外显子 1 和内含子的核苷酸序列。右图:外显子 24 和 25,包括内含子。外显子以大写字母表示,并标明氨基酸序列。SPUD 数据库中包含的品种的小核苷酸多态性 (SNP) 以红色标记,Saturna 中发现的 SNP 以下划线表示。灰色箭头表示 gRNA(gA、gB、gC、gD、gE、gI、gJ、gK、gL 和 gM),其中 PAM 位点以粗体标记。红色箭头表示诊断性 IDAA PCR 引物。 “ CFATC ” 区域含有半胱氨酸,据推测该区域参与二硫键间或二硫键内形成,因此推测参与 GWD 活性的氧化还原状态调节,该区域以粗体标记。活性位点组氨酸残基也以粗体标记。