XiaoMi-AI文件搜索系统
World File Search System免疫 PET 检测抗体药物效力...
靶向人类表皮生长因子受体 2 (HER2) 的曲妥珠单抗美坦辛 (T-DM1) 和曲妥珠单抗德鲁替康 (T-DXd) 是临床上用于治疗 HER2 阳性乳腺癌的抗体 - 药物偶联物 (ADC),后者于 2021 年获得临床批准,用于治疗 HER2 阳性胃癌。洛伐他汀是一种降胆固醇药物,它暂时提高细胞表面 HER2,从而增强 HER2-ADC 结合和内化。方法:在 NCIN87 胃异种移植模型和胃患者来源的异种移植模型中,我们使用 89 Zr 标记或 64 Cu 标记的抗 HER2 抗体曲妥珠单抗来研究 ADC 治疗与洛伐他汀联合给药和不联合给药的给药方案。我们比较了多剂量 ADC 方案(复制临床剂量方案标准)与单剂量方案的 ADC 功效。结果:无论是多剂量还是单剂量 T-DM1 给药,T-DM1/洛伐他汀治疗均可抑制肿瘤生长。单剂量洛伐他汀与 T-DM1 或 T-DXd 共同给药可增强肿瘤生长抑制,同时伴有 HER2 靶向免疫 PET 信号的减弱和细胞水平上 HER2 介导的信号减弱。体外 ADC 治疗可增加 DNA 损伤信号。结论:我们从胃癌异种移植中获得的数据表明,HER2 靶向免疫 PET 可用于告知肿瘤对 ADC 疗法与细胞表面靶点可用性调节剂联合使用的反应。我们的研究还证明,他汀类药物能够增强细胞系和患者来源的异种移植模型中的 ADC 功效,从而实现单剂量 ADC 给药。
第 43 版 - 变更摘要 - 2024 年 11 月
DIN/PIN 产品名称 规格 剂型 制造商 DBP/单价 02244393 Apo-Cefuroxime 250mg Tab APX 0.4194 02244394 Apo-Cefuroxime 500mg Tab APX 0.8308 02344823 Auro-Cefuroxime 250mg Tab AUR 0.4194 02344831 金头孢呋辛 500mg 片剂 AUR 0.8308 02220172 洛伐他汀 20mg 片剂 AAP 1.1931 02220180 洛伐他汀 40mg 片剂 AAP 2.1793 02498731 天然镧 250mg 咀嚼片 NAT 1.2034 02498758镧 500mg 咀嚼片 NAT 2.4069 02498766 镧 750mg 咀嚼片 NAT 3.6219 02498774 镧 1000mg 咀嚼片 NAT 4.8018 02230090 己酮可可碱 SR 400mg SR 片 AAP 0.7238 00445274 硫酸盐 400mg & 80mg 片 AAP 0.2184
lovastatin通过细胞骨架相关蛋白的失调
组小于对照组的组(p <0.05)。对于接收MDA-MB-453 CSC的小鼠,与对照组相比,lovastatin治疗组的平均肿瘤体积甚至更大(P <0.05)(附加文件4:图S3A)。实验结束时肿瘤重量分析证实了肿瘤体积测量的结果(附加文件4:图S3B)。 进行免疫组织化学染色以评估原位肿瘤上与EMT相关的蛋白质。 我们发现,在从MDA-MB-231 CSC衍生的异种移植肿瘤中,洛伐他汀治疗的组的间充质标记和扭曲的分数低于对照组(p <0.05)。 再次,在MDA-MB-453 CSC肿瘤中,波形蛋白和lovastatin治疗组之间没有统计学差异肿瘤重量分析证实了肿瘤体积测量的结果(附加文件4:图S3B)。进行免疫组织化学染色以评估原位肿瘤上与EMT相关的蛋白质。我们发现,在从MDA-MB-231 CSC衍生的异种移植肿瘤中,洛伐他汀治疗的组的间充质标记和扭曲的分数低于对照组(p <0.05)。再次,在MDA-MB-453 CSC肿瘤中,波形蛋白和lovastatin治疗组之间没有统计学差异
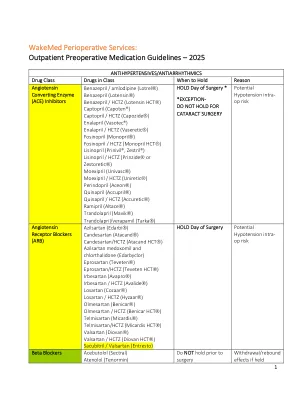
门诊术前用药指南 – 2025 年
依普利酮 (Inspra ® ) 依他尼酸 (Edecrin ) 呋塞米 (Lasix®) 氢氯噻嗪 (Microzide , Esidrix®) 吲达帕胺 (Lozol ) 美托拉宗 (Zaroxolyn ) 甲唑胺 甲氯噻嗪 美托拉宗 (Zaroxoxlyn ) 螺内酯 (Aldactone ) 螺内酯 / 氢氯噻嗪 (Aldactazide ) 托拉塞米 (Demadex ) 氨苯蝶啶 (Dyrenium ) 氨苯蝶啶 / HCTZ (Dyazide , Maxzide ) 他汀类药物 阿托伐他汀 (Lipitor) 氟伐他汀 (Lescol) 洛伐他汀(Mevacor) 匹伐他汀(Livalo) 普伐他汀(Pravachol) 瑞舒伐他汀(Crestor) 辛伐他汀(Zocor)
开发用于治疗高脂血症的新型基因组编辑工具
基因组编辑是指修改生物体的 DNA 以改变其遗传信息。最有前途的基因组编辑工具之一是 CRISPR-Cas9,它代表成簇的规律间隔短回文重复序列 (CRISPR) 和 CRISPR 相关蛋白 9 (Cas-9)。CRISPR-Cas9 允许科学家通过靶向特定基因并引入修饰来精确改变 DNA 序列 [ 1 , 2 ]。在高胆固醇血症的情况下,主要目标是靶向参与胆固醇代谢的基因,以降低血液中的低密度脂蛋白 (LDL) 胆固醇水平。由于肝脏在脂蛋白颗粒的产生和清除中起着关键作用,因此基因组编辑策略经过优化以靶向肝细胞内的基因。例如,基于血清型 8 的腺相关病毒 (AAV) 载体对肝脏有特异性的趋向性,已在多项小鼠体细胞基因组编辑研究中用于 [3,4]。脂质纳米颗粒 (LNP) 也是 CRISPR-Cas9 编辑的运载载体,由于其能够与血清蛋白相互作用,可被肝细胞有效吸收 [5]。研究人员一直在探索利用基因组编辑开发新疗法,以替代现有疗法,包括他汀类药物、依折麦布、PCSK9(前蛋白转化酶枯草溶菌素/kexin 9 型)抑制剂、烟酸、胆汁酸螯合剂、纤维酸盐和贝伐单抗酸 [6-9]。他汀类药物在 20 世纪 80 年代末首次用于治疗高胆固醇。第一个被批准用于临床的他汀类药物是 1987 年的洛伐他汀 (Mevacor)。洛伐他汀获批后,其他他汀类药物也相继被开发并用于治疗高胆固醇血症。一些常用的他汀类药物包括辛伐他汀 (Zocor)、阿托伐他汀 (Lipitor)、普伐他汀 (Pravachol) 和瑞舒伐他汀 (Crestor)。虽然他汀类药物被认为是安全有效的,但使用时会出现不同的副作用,包括肌肉疼痛和无力、胃肠道症状和肝酶异常,这导致了替代疗法或补充疗法的发展 [ 10 , 11 ]。依折麦布通常被认为是无法耐受他汀类药物或需要进一步降低 LDL 水平的个人的有效选择 [ 12 ]。这种药物通过减少胆固醇从血管中吸收而起作用。
使用大脑网络诊断阿尔茨海默氏病
丝状真菌具有产生各种具有不同生物学活性和结构(例如洛伐他汀和瑞士宁)的二级代谢产物的能力。随着后基因组时代的出现,越来越多的隐性或未表征的次级代谢物生物合成基因簇不断被发现。然而,由于长期缺乏多功能,相对简单且高度有效的遗传操纵技术,迄今为止,对工业重要的次级代谢产物的更广泛探索已经受到阻碍。随着基于CRISPR/CAS9的基因组编辑技术的出现,这一难题可能会得到缓解,因为这项先进的技术彻底改变了遗传研究,并使纤维化真菌的剥削和发现可以剥削和发现新的生物活性化合物。在这篇评论中,我们详细介绍了CRISPR/CAS9系统,并总结了CRISPR/CAS9介导的基因组编辑的最新应用。我们还介绍了CRISPR/CAS9系统的特定应用和CRISPRA在改善次级代谢物含量的改善中,并发现了新型生物活性化合物在纤维真菌中的发现,并提供了特定的例子。此外,我们强调并讨论了使用基于CRISPR/CAS9的基因组编辑技术在次生代谢物的生物合成研究中以及CRISPR/CAS9策略在明亮真菌中的未来应用中的某些挑战和确定。
他汀类药物在癌症治疗中的创新潜力:新疗法的新靶点
迄今为止,文献中描述了多种类型的癌症,许多相关治疗方法也在不断发展。在许多形式的癌症中,观察到脂质代谢(Fritz 等人,2013 年)和甲羟戊酸途径 (MVP) 的失调(Freed-Pastor 等人,2012 年)。胆固醇是细胞膜不可或缺的组成部分,它是胆汁酸、脂蛋白和类固醇激素的前体。它的生物合成受 MVP 控制,而 MVP 控制蛋白质法呢基化和香叶基化。这些翻译后修饰对于 Ras、Rho 或 Rac 蛋白的下游信号传导活性至关重要,这些蛋白属于小 GTPases 超家族 ( Takai 等人,2001 ),参与肿瘤发生、进展 ( Buhaescu 和 Izzedine,2007 )、增殖、迁移和肿瘤细胞存活 ( Kidera 等人,2010 )。与健康细胞一样,癌细胞也会酯化磷脂中的脂肪酸,而磷脂是细胞膜必需成分。这些必需的脂质是通过源自 MVP 的内源性代谢物获得的 ( Notarnicola 等人,2014 )。抑制这一重要过程可能对癌细胞有益,因为它们通常快速增殖,而不会影响太多繁殖速度较慢的健康细胞。他汀类药物能够通过抑制 HMG-CoA 还原酶 (HMGCR) 来降低血浆中的脂质水平。多项研究表明,他汀类药物的使用与癌症之间存在密切的相关性。第一项有希望的研究表明,他汀类药物能够改善癌症的预后,即延长生存时间(Gupta 等人,2019 年)。在这篇小型评论中,我们想阐明关于单独或与其他药物联合使用他汀类药物(如辛伐他汀、氟伐他汀和洛伐他汀)治疗癌症的新观点和创新目标。