XiaoMi-AI文件搜索系统
World File Search System轴向银屑病关节炎和射线镜轴向脊椎关节炎之间的遗传和分子区别:四个3期临床试验的事后分析
和HLA-C12等位基因。与R-AXSPA相比,AXPSA患者的基线水平升高,血清IL-17A和IL-17F细胞因子,IL-17和IL-10途径相关基因的富集以及中性粒细胞基因标记物的富集。在AXPSA和非AXPSA队列中,细胞因子水平的降低以及与Guselkumab治疗相关的基因表达的归一化是可比的。结论:HLA遗传关联,血清细胞因子和富集分数的差异支持AXPSA和R-AXSPA可能是不同的疾病的概念。Guselkumab对AXPSA和非AXPSA患者观察到的细胞因子水平和与途径相关的基因的综合药效学作用与在PSA队列中证明的临床改善一致。这些发现有助于理解AXPSA和R-AXSPA之间的潜在遗传和分子区别。试验注册:ClinicalTrials.gov识别剂,NCT03162796,NCT0315828,NCT02437162和NCT02438787。
用免疫检查点抑制剂治疗后的细胞因子释放综合征:瑞典Karolinska大学医院的2672名患者的观察队列研究
1。Bagchi,S.,R。Yuan和E.G. Engleman,治疗270癌症的免疫检查点抑制剂:临床影响和反应和抗性机制。 Annu Rev Pathol,2021。 271 16:p。 223-249。 272 2。 yin,Q。等,免疫相关的免疫检查点抑制剂的不良事件:综述。 273前免疫,2023。 14:p。 1167975。 274 3。 Haanen,J。等人,免疫疗法的毒性管理:ESMO临床实践275诊断,治疗和随访指南。 Ann Oncol,2022。 33(12):p。 1217-1238。 276 4。 Naidoo,J。等人,癌症免疫疗法学会(SITC)共识定义277个免疫检查点抑制剂相关的免疫相关的不良事件(IRAES)术语。 J 278免疫癌症,2023年。 11(3)。 279 5。 Martins,F。等,免疫检查抑制剂的不良影响:流行病学,280管理和监视。 nat Rev Clin Oncol,2019年。 16(9):p。 563-580。 281 6。 Liu,L.L。等人,全身性炎症综合征作为免疫282检查点抑制剂的生命副作用:病例报告和文献的系统评价。 J免疫283癌症,2023年。 11(3)。 284 7。 Frey,N。和D. Porter,带有嵌合抗原受体T细胞285治疗的细胞因子释放综合征。 生物血骨髓移植,2019年。 25(4):p。 E123-E127。 286 8。 Ann Oncol,2021。 32(1):p。 34-48。 288 9。Bagchi,S.,R。Yuan和E.G.Engleman,治疗270癌症的免疫检查点抑制剂:临床影响和反应和抗性机制。Annu Rev Pathol,2021。271 16:p。 223-249。272 2。yin,Q。等,免疫相关的免疫检查点抑制剂的不良事件:综述。273前免疫,2023。14:p。 1167975。274 3。Haanen,J。等人,免疫疗法的毒性管理:ESMO临床实践275诊断,治疗和随访指南。 Ann Oncol,2022。 33(12):p。 1217-1238。 276 4。 Naidoo,J。等人,癌症免疫疗法学会(SITC)共识定义277个免疫检查点抑制剂相关的免疫相关的不良事件(IRAES)术语。 J 278免疫癌症,2023年。 11(3)。 279 5。 Martins,F。等,免疫检查抑制剂的不良影响:流行病学,280管理和监视。 nat Rev Clin Oncol,2019年。 16(9):p。 563-580。 281 6。 Liu,L.L。等人,全身性炎症综合征作为免疫282检查点抑制剂的生命副作用:病例报告和文献的系统评价。 J免疫283癌症,2023年。 11(3)。 284 7。 Frey,N。和D. Porter,带有嵌合抗原受体T细胞285治疗的细胞因子释放综合征。 生物血骨髓移植,2019年。 25(4):p。 E123-E127。 286 8。 Ann Oncol,2021。 32(1):p。 34-48。 288 9。Haanen,J。等人,免疫疗法的毒性管理:ESMO临床实践275诊断,治疗和随访指南。Ann Oncol,2022。33(12):p。 1217-1238。276 4。Naidoo,J。等人,癌症免疫疗法学会(SITC)共识定义277个免疫检查点抑制剂相关的免疫相关的不良事件(IRAES)术语。J 278免疫癌症,2023年。11(3)。279 5。Martins,F。等,免疫检查抑制剂的不良影响:流行病学,280管理和监视。 nat Rev Clin Oncol,2019年。 16(9):p。 563-580。 281 6。 Liu,L.L。等人,全身性炎症综合征作为免疫282检查点抑制剂的生命副作用:病例报告和文献的系统评价。 J免疫283癌症,2023年。 11(3)。 284 7。 Frey,N。和D. Porter,带有嵌合抗原受体T细胞285治疗的细胞因子释放综合征。 生物血骨髓移植,2019年。 25(4):p。 E123-E127。 286 8。 Ann Oncol,2021。 32(1):p。 34-48。 288 9。Martins,F。等,免疫检查抑制剂的不良影响:流行病学,280管理和监视。nat Rev Clin Oncol,2019年。16(9):p。 563-580。281 6。Liu,L.L。等人,全身性炎症综合征作为免疫282检查点抑制剂的生命副作用:病例报告和文献的系统评价。 J免疫283癌症,2023年。 11(3)。 284 7。 Frey,N。和D. Porter,带有嵌合抗原受体T细胞285治疗的细胞因子释放综合征。 生物血骨髓移植,2019年。 25(4):p。 E123-E127。 286 8。 Ann Oncol,2021。 32(1):p。 34-48。 288 9。Liu,L.L。等人,全身性炎症综合征作为免疫282检查点抑制剂的生命副作用:病例报告和文献的系统评价。J免疫283癌症,2023年。11(3)。284 7。Frey,N。和D. Porter,带有嵌合抗原受体T细胞285治疗的细胞因子释放综合征。生物血骨髓移植,2019年。25(4):p。 E123-E127。286 8。Ann Oncol,2021。32(1):p。 34-48。288 9。Schubert,M.L。等,嵌合抗原受体(CAR)T-Cell 287治疗的副作用管理。Yomota,M。等,免疫检查点抑制剂289治疗非小细胞肺癌的细胞因子释放综合征。实习医学,2021年。60(21):p。 3459-3462。290
毒性和细胞因子从人牙纸浆干细胞中释放出暴露于单个峰和多波LED固化的通用牙齿粘合剂后
目标:评估单峰和多波LED固化的通用粘合剂的影响,对人牙浆干细胞(HDPSC)的代谢活性和细胞因子释放的影响。另外,分析用不同LED固化的粘合剂的转化程度(DC)。方法:使用三种通用粘合剂制备圆盘(直径为5 mm,厚1毫米):单键Uni Versal(SBU,3 M ESPE),Optibond Universal(OBU,Kerr)和Zipbond Universal(ZBU,SDI)。使用单峰(DeepCure,3 M ESPE)或PolyWave轻射二极管(LED)固化单元(Valo Grand,Ultrapent)将这些圆盘固化40 s。24小时后,将样品放在24孔培养板中,每个培养板含有1 ml培养基24小时。将HDPSC(1.8×10 4)接种在96孔板中,并允许生长24小时。随后,将细胞暴露于提取物(含有粘合剂碟片的培养基)的提取物(培养基)中,再加上24小时。未暴露于提取物的细胞用作对照组。使用MTT分析和通过Magpix评估的细胞因子释放评估线粒体代谢。使用FTIR分析粘合剂的转化程度(n = 5)。通过方差分析的双向和Tukey的测试对结果进行了分析。结果:OBU和ZBU洗脱液在线粒体代谢上导致统计学上显着降低,而不论所用的LED如何,表明它们的细胞毒性。相比之下,SBU并未显着影响MTT结果,类似于对照组。与ZBU相关的细胞因子IL-1,IL-6,IL-10和TNF-α的释放较高。SBU增加了IL-8的释放。OBU不影响细胞因子释放。SBU呈现较高的直流,而OBU和ZBU的DC相似,低于SBU。的意义:总之,通用粘合剂对HDPSC表现出毒性,但毒性程度因粘合剂而异。ZBU与HDPSCS的细胞因子释放量增加有关,尤其是促炎性介质。不同的LED不影响评估粘合剂的细胞毒性。
维生素C
关于Covid-19,据信免疫反应涉及炎性和抗炎细胞因子之间的复杂相互作用。 几项研究报道了由COVID-19的患者的细胞因子和趋化因子的异常水平(8)。 大流行,Blanco-Mello等。 表明,合并症患者的不适当和弱免疫反应出现的频率更高(9)。 当人体对病毒的自然防御措施被削弱并大量产生炎症性细胞因子时,SARS-COV-2感染可能会有一个转折点(9)。 在许多患有严重兴奋的促炎细胞因子(例如肿瘤坏死因子(TNF))的血清水平较高的患者中,与患有轻度疾病(10、11)相比,已经观察到较高的肿瘤坏死因子(TNF) - α,α,白介素(IL)-1β,IL-2和IL-6以及IL-8等趋化因子。 这表明COVID-19的发病机理涉及T-Helper细胞(Th)亚群(包括TH1,TH2和TH17)以及调节性T细胞(Tregs)的不平衡。关于Covid-19,据信免疫反应涉及炎性和抗炎细胞因子之间的复杂相互作用。几项研究报道了由COVID-19的患者的细胞因子和趋化因子的异常水平(8)。大流行,Blanco-Mello等。表明,合并症患者的不适当和弱免疫反应出现的频率更高(9)。当人体对病毒的自然防御措施被削弱并大量产生炎症性细胞因子时,SARS-COV-2感染可能会有一个转折点(9)。在许多患有严重兴奋的促炎细胞因子(例如肿瘤坏死因子(TNF))的血清水平较高的患者中,与患有轻度疾病(10、11)相比,已经观察到较高的肿瘤坏死因子(TNF) - α,α,白介素(IL)-1β,IL-2和IL-6以及IL-8等趋化因子。这表明COVID-19的发病机理涉及T-Helper细胞(Th)亚群(包括TH1,TH2和TH17)以及调节性T细胞(Tregs)的不平衡。
血清白细胞介素22作为在银屑病关节炎中分子靶向药物差异使用的生物标志物的影响:一项回顾性研究
然后,在TNF-I处理的组(24例)和IL-17-I-I-I-I-I-I-I-I-I-I-I-I-I-I-I-I-I-I-I-I-I-I-I-I-I-I-Cheat则进行了单变量的逻辑分析,并将DAPSA-REM,PASI90和最小疾病活性作为客观变量作为目标变量和血清细胞因子浓度作为爆炸性变量。血清IL-22浓度被确定为有助于IL-17-I-I-I-i-i-i-i-teal群中DAPSA-REM实现的因素。然而,尚未将基线血清细胞因子鉴定为有助于达到TNF-I-READ群体中DAPSA-REM的因素,或在任何一组中的PASI90和PASI90的实现和最小疾病活性(补充表S4)。我们比较了获得DAPSA-REM(12例),未(12例)的患者中的基线血清细胞因子浓度,在TNF-I-I-I-I-I-17-17-I-I-I-I-I-I-I-I-I-I-I-I-CHEAT组中则(分别为11例和12例)。结果
通过连续靶向治疗改善肿瘤反应
靶向 a 疗法 (TAT) 向肿瘤输送高线性转移能量 a 粒子,有可能产生肿瘤免疫反应,而抗原靶向免疫疗法可能会增强这种反应。方法:在携带 CEA 阳性乳腺或结肠肿瘤的免疫功能正常的癌胚抗原 (CEA) 转基因小鼠中评估了这一概念。用 225 Ac 标记的人源化抗 CEA 抗体 M5A 靶向肿瘤,该抗体 10 天半衰期和 4 a 粒子发射,以及用免疫细胞因子 M5A - 白细胞介素 2 靶向肿瘤。结果:仅对原位 CEA 阳性乳腺肿瘤观察到 TAT 的剂量反应(3.7、7.4 和 11.1 kBq),最高剂量下肿瘤生长延迟 30 天,中位生存期从 20 天增加到 36 天。免疫细胞因子(每日 4 次)单一疗法使肿瘤生长延迟 20 天,在开始使用免疫细胞因子 5 天后添加 7.4 kBq TAT 并没有改善这一情况。但是,TAT(7.4 kBq)和 10 天后使用免疫细胞因子使肿瘤生长延迟 38 天,中位生存期增加至 45 天。TAT 和 10 天后使用免疫细胞因子的结果相似。当对皮下植入 CEA 阳性 MC38 结肠肿瘤进行类似研究时,TAT(7.4 kBq)单一疗法使中位生存期从 29 天增加至 42 天。7.4 kBq TAT 后 10 天添加免疫细胞因子使中位生存期增加至 57 天。免疫表型分析显示,序贯疗法中肿瘤内滤过性干扰素 γ 阳性、CD8 阳性 T 细胞增加,且这些细胞与 Foxp3 阳性、CD4 阳性调节性 T 细胞的比例增加。免疫组织化学证实序贯疗法组中肿瘤内滤过性 CD8 阳性 T 细胞增加,强烈提示免疫细胞因子增强 TAT 可导致免疫反应,从而改善肿瘤治疗。结论:在乳腺癌和结肠癌肿瘤模型中,与单一疗法相比,低剂量(7.4 kBq)TAT,随后 5 天或 10 天后使用 4 剂量免疫细胞因子方案可获得更佳的肿瘤缩小率和生存曲线。在乳腺癌模型中,将治疗顺序反转为免疫细胞因子,随后 5 天后使用 TAT 相当于单一疗法。
JAK抑制剂破坏T细胞诱导的促炎...
抽象目标巨噬细胞子集被T细胞激活,越来越多地被认为在类风湿关节炎(RA)发病机理中起着核心作用。Janus激酶(JAK)抑制剂在RA中已证明有益的临床作用。在这项研究中,我们研究了JAK抑制剂对细胞因子激活T(TCK)细胞产生的影响以及TCK细胞/巨噬细胞相互作用诱导的细胞因子和趋化因子的产生。方法CD14 +单核细胞和CD4 + T细胞从健康供体的Buffy毛皮中纯化从外周血单核细胞中纯化。作为代表性的JAK抑制剂,tofacitinib或ruxolitinib。先前验证的方案分别用于从单核细胞和CD4 + T细胞中生成巨噬细胞和TCK细胞。细胞因子和趋化因子,包括TNF,IL-6,IL-15,IL-RA,IL-10,MIP1α,MIP1β和IP10。结果JAK抑制剂阻止了细胞因子诱导的TCK细胞成熟,并降低了促炎性细胞因子TNF,IL-6,IL-15,IL-15,IL-1RA和趋化因子IL-10,MIP1α,MIP1α,MIP1β,IP10,由TCK细胞通过TCK细胞通过TCK Cell-inded Moclated Moclated Moclophages(Vitro)(p <0.0)。结论我们的发现表明,JAK抑制会破坏T细胞诱导的巨噬细胞激活,并减少下游促炎细胞因子和趋化因子反应,这表明抑制T细胞巨噬细胞相互作用有助于JAK抑制剂的治疗作用。
苦瓜的免疫调节剂活性(Momordica
摘要:细胞因子是由人体细胞分泌的肽或蛋白质,作为由于异物,细菌,病毒或进入人体的寄生虫而导致的细胞间交流和功能作为身体防御的培养基。在调节肺疟原虫寄生虫消除疟原虫中起重要作用的细胞因子之一是IFN-γ细胞因子。IFN-γ细胞因子是一种细胞因子,在单纯疟疾患者中消除疟疾寄生虫中起作用。 病例报告一名年轻的18岁年轻人,重36公斤,发烧,进行体格检查,医生诊断出寄生虫学为单独的falsodium falsodium falsodium falsodium falsodium疟疾,无性寄生虫计数为4211/µl。 年轻人每天1倍苦味苦瓜提取物3天。 在D0(31.27 pg/mL)和D1(6.42 pg/mL)上进行IFN-γ细胞因子检查。 D1中的寄生虫检查为826/µL),D2为123/µL,D3,D4,D7,D14,D14,D21,D28没有无性寄生虫和配子细胞。 血液学,临床化学,血脂和血糖检查在D0,D14和D28上进行,结果仍在正常范围内。 报告的临床症状是无力,头痛,头晕,发冷,恶心,腹痛,肌肉疼痛和发烧,这些临床症状已被D4消失。 结论苦瓜提取物通过减少IFN-γ细胞因子的机制,即免疫调节标记之一。IFN-γ细胞因子是一种细胞因子,在单纯疟疾患者中消除疟疾寄生虫中起作用。病例报告一名年轻的18岁年轻人,重36公斤,发烧,进行体格检查,医生诊断出寄生虫学为单独的falsodium falsodium falsodium falsodium falsodium疟疾,无性寄生虫计数为4211/µl。年轻人每天1倍苦味苦瓜提取物3天。在D0(31.27 pg/mL)和D1(6.42 pg/mL)上进行IFN-γ细胞因子检查。 D1中的寄生虫检查为826/µL),D2为123/µL,D3,D4,D7,D14,D14,D21,D28没有无性寄生虫和配子细胞。 血液学,临床化学,血脂和血糖检查在D0,D14和D28上进行,结果仍在正常范围内。 报告的临床症状是无力,头痛,头晕,发冷,恶心,腹痛,肌肉疼痛和发烧,这些临床症状已被D4消失。 结论苦瓜提取物通过减少IFN-γ细胞因子的机制,即免疫调节标记之一。在D0(31.27 pg/mL)和D1(6.42 pg/mL)上进行IFN-γ细胞因子检查。D1中的寄生虫检查为826/µL),D2为123/µL,D3,D4,D7,D14,D14,D21,D28没有无性寄生虫和配子细胞。血液学,临床化学,血脂和血糖检查在D0,D14和D28上进行,结果仍在正常范围内。报告的临床症状是无力,头痛,头晕,发冷,恶心,腹痛,肌肉疼痛和发烧,这些临床症状已被D4消失。结论苦瓜提取物通过减少IFN-γ细胞因子的机制,即免疫调节标记之一。
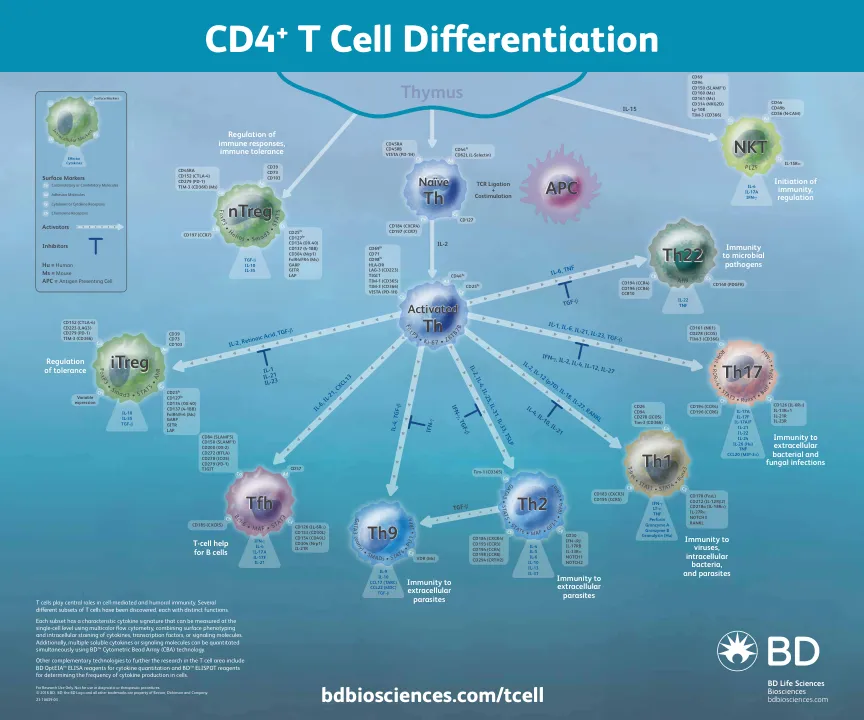
CD4+ T细胞分化海报
每个子集都有一个特征性的细胞因子特征,可以在单细胞水平上使用多色流细胞术在单细胞水平上测量,结合了细胞因子的表面表型和细胞内染色,转录因子或信号分子。此外,可以使用BD™细胞量仪阵列(CBA)技术同时定量多个可溶性细胞因子或信号分子。
患者:CRS和ICANS的管理
随着T细胞繁殖并攻击癌细胞,它们可以释放出大量的蛋白质(称为细胞因子)中的血液,这可以过度刺激您的免疫系统。这被称为细胞因子释放综合征或CRS。如果发生这种情况,通常会在治疗开始时,当您接受免疫疗法的前几剂时。为了防止CR,您的免疫疗法可能以较低的剂量开始,并且随着时间的流逝而缓慢增加。