XiaoMi-AI文件搜索系统
World File Search SystemTdap 和联合疫苗
疫苗:建议 7 岁以下儿童接种 DTaP 疫苗系列。如果 7 岁以下儿童在接种第一剂 DTaP 后出现百日咳疫苗禁忌症,则可以使用与 DTaP 相同的接种时间表,按照说明书外规定接种所有推荐的剩余剂量的 Td。请注意,DTaP 中百日咳成分的唯一禁忌症是接种疫苗后 7 天内出现脑病,且不能归因于其他原因,并且用 Td 代替 DTaP 接种的儿童对白喉的保护作用可能不理想。10,11
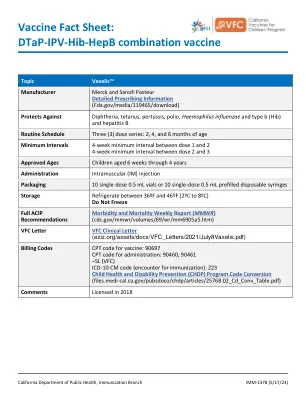
DTaP-IPV-Hib-HepB 联合疫苗
账单代码 疫苗的 CPT 代码:90697 给药的 CPT 代码:90460, 90461 –SL (VFC) ICD-10-CM 代码(免疫接种):Z23 儿童健康和残疾预防 (CHDP) 计划代码转换(files.medi-cal.ca.gov/pubsdoco/chdp/articles/25768.02_Cd_Conv_Table.pdf)
流感和 COVID-19 联合疫苗的偏好:结果来自
Combo = 流感和 COVID-19 疫苗组合;Stand-alone = 独立流感疫苗。注意:风险承受能力最高区间的受访者(愿意接受 30% 或更高的中度至重度全身副作用风险)被问及一个开放式问题,即在将他们的选择从组合疫苗转换为独立流感疫苗之前,他们愿意接受的最大中度至重度全身副作用风险。
成人季节性呼吸道联合疫苗
目前促进患者获得疫苗的系统和计划侧重于儿童疫苗覆盖率和支付模式,并未考虑到成人联合疫苗。因此,关于如何修改疫苗获取系统以支持获得这些新产品仍存在疑问。本文讨论了当前有关疫苗产品审批、免疫实践咨询委员会 (ACIP) 建议、付款人覆盖和提供者支付的政策如何影响患者获得新型成人联合疫苗。评估特别侧重于对流感-COVID-19 联合疫苗的考虑,因为有多种后期候选疫苗正在开发中,预计将在未来几年推出。本文讨论的许多考虑因素也可能适用于未来可能推出的其他成人联合疫苗。
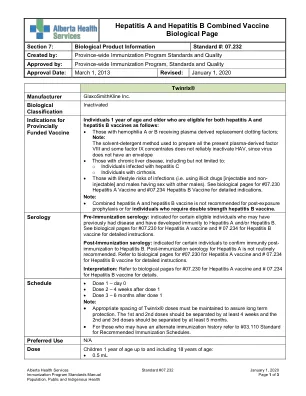
07.232 甲肝和乙肝联合疫苗生物学页面
符合以下条件的 1 岁及以上人士可以接种甲肝和乙肝疫苗:• 接受血浆来源的替代凝血因子的 A 或 B 型血友病患者;注意:用于制备所有现有血浆来源的 VIII 因子和一些 IX 因子浓缩物的溶剂-洗涤剂法不能可靠地灭活 HAV,因为病毒没有包膜。• 患有慢性肝病的人,包括但不限于:o 感染丙型肝炎的人o 肝硬化的人。• 有感染生活方式风险的人(即使用非法药物 [注射和非注射] 和男性与其他男性发生性关系)。有关详细适应症,请参阅生物学页面上的 #07.230 甲型肝炎疫苗和 #07.234 乙肝疫苗。注意:• 不建议将甲肝和乙肝联合疫苗用于暴露后预防,也不建议用于需要双倍强度乙肝疫苗的个人。
猪细小病毒联合疫苗生产及标准化
传染病的严重性仍然是畜牧业经济可行性的主要制约因素。针对多种传染病的联合疫苗可降低疫苗接种的成本、时间和劳动量。在本研究中,使用多杀性巴氏杆菌 P 52 菌株和梭菌 49 菌株制备了针对出血性败血症和黑季病的正式疫苗。将这两种疫苗的不同比例混合以配制各种联合疫苗组,随后对其进行无菌性、安全性和效力标准化。在所有组合中,我们发现包含 1 ml HS 酪蛋白蔗糖酵母提取物琼脂洗涤疫苗和 4 ml BQ 巯基乙酸盐肉汤和培养疫苗(摇动)的组合最有效。在对单个疫苗进行的效力测试中,这种联合疫苗分别对兔子和豚鼠产生了 100% 的 HS 病保护率和 75% 的 BQ 病保护率。研究还表明,酪蛋白蔗糖酵母琼脂和液体硫代乙醇酸盐肉汤是培养巴氏杆菌和肖沃氏梭菌的更好培养基。与静态培养相比,在振荡器上培养时,肖沃氏梭菌的生长速度更快。
Tdap——破伤风-白喉-无细胞百日咳联合疫苗……
4. 国家免疫咨询委员会。咨询委员会声明 (ACS) 国家免疫咨询委员会 (NACI):妊娠期破伤风类毒素、减毒白喉类毒素和减毒无细胞百日咳 (Tdap) 疫苗免疫的最新进展。[互联网]。2018 年)。[2018 年 2 月 1 日引用]。第 33 页。可从以下网址获取:https://www.canada.ca/content/dam/phac-aspc/documents/services/publications/healthy-living/update-immunization- pregnancy-tdap-vaccine/update-immunization-pregnancy-tdap-vaccine-eng.pdf