XiaoMi-AI文件搜索系统
World File Search System评论文章心源性肺水肿
摘要:心源性肺水肿的当前传统病理生理概念通过静水作用来解释其发育,这是由于肺毛细管压力增加,导致毛细血管的肺泡和间质区域的流体通量。然而,在许多情况下,对血液动力学和利尿剂治疗反应不良的一些实验研究和临床数据提供了进一步的证据,证明了其他几种导致心脏病性肺水肿发展的因素。一些实验和临床研究发现,血浆儿茶酚胺浓度升高的交感神经过度活动可能在心血管相关肺水肿的发展中起重要作用。儿茶酚胺诱导的PULMO损伤可能是急性心源性肺水肿的关键机制之一,触发促炎细胞因子过度活化,氧化应激和心肌损伤。在日常治疗急性心力衰竭时,医生应考虑参与急性肺水肿进展的其他非心源性机制的可能性,尤其是儿茶酚胺过度活跃,淋巴引流,炎症性和氧化应激,高表面活性剂。肺水肿的经典,血液动力学方法与其他因素的共存可能无法在治疗过程中提供足够的临床益处。
心力衰竭患者高压氧疗法的安全性:一项回顾性队列研究
HFMEF(平均LVEF 44±4%)。除一名患者以外的所有患者都接受了循环利尿剂或透析的液体平衡疗法。21名患者完成HBOT而没有并发症。我们观察到两名患者的症状与HBOT相关的HF恶化一致。一名患有HFREF(LVEF 24%)的患者在第四次治疗后患上呼吸困难归因于肺水肿,后来在会议前承认自愿持有利尿剂。他以增加的口服利尿剂为门诊,最终毫无明显地完成了33次HBOT课程。另一位患有HFPEF(LVEF 64%)的患者在六次课程后患有呼吸困难和饱和性,需要入院。排除了急性冠状动脉缺血和肺栓塞,而回声图上的BNP和正常LVEF升高证实了HFPEF背景下肺水肿的诊断。利尿剂治疗后症状消退,患者处于稳定状态,但当选不恢复HBOT。
儿科患者中心包减压综合征
心包减压综合征(PDS)是心包引流的罕见但关键的综合。它与心包引流最相关,可以治疗心脏润肤膜,但也可以在不预先填充棉花生理学的情况下发生。心包引流通常会形成,以减轻心脏的外部压缩,以帮助恢复正常的心脏功能。在PDS中,心包积液引流后,患者自相矛盾的是血流动力学不稳定性和心室功能障碍的肺水肿。一名4岁男孩,患有慢性肉芽肿病史(CGD),最终接受了单倍性造血干细胞移植(HSCT),需要长时间住院治疗多种感染和疾病。他的临床过程使他经历了心包积液的开发变得复杂。手术后不久,患者的血液动力学和肺水肿发育恶化。工作显示新的右心衰竭最终归因于PD。此病例将PDS强调为儿科患者中与心包酶的潜在风险。
基于...
该病毒使用存在于其表面上的尖峰蛋白来识别其细胞表面接收器,即血管紧张素2(ECA 2)的转化酶,进入宿主细胞细胞质和复制(Chugh等,2021年)。该病毒探索了宿主的细胞机制以获取细胞的访问:其尖峰蛋白被连接ECA2后立即从宿主细胞表面的跨膜蛋白酶2(TMPRS2)丝氨酸切割,然后在叶片裂解位点进行蛋白水解活化。该病毒主要到达呼吸道的上皮,该呼吸道被强烈调节的气道表面的一层液体覆盖,该液体是针对呼吸道病原体的主要防御机制。该流体层的体积和粘度受呼吸上皮中不同运输道路的协调功能调节和维持。研究人员认为,SARS-COV-2可以显着改变接收器信号通路与GPCR(GPCR)耦合,从而改变了阴离子分泌和吸收钠的微妙平衡,从而控制了该流体层的稳态,从而减少了离子和肺部液体的运输。因此,病理生理级联反应开始,导致肺水肿,肺水肿是COVID -19的最严重和可能致命的临床表现之一(Hameid等,2021)。
检查
心血管系统。1。心血管疾病患者的投诉。2。检查心血管疾病的患者。3。心跳和心脏刺激,发生的原因,诊断价值。4。Apex拍打,其特征,病理变化。5。相对和绝对心脏钝化,病理的变化。6。正常心脏轮廓,病理构型。7。脉冲及其特征。8。我心脏声音,形成的机理。I心脏声音变化的诊断价值(强化,弱化,分裂)。9。ii心脏声音,形成的机理。II心脏声音变化的诊断价值(强化,弱化,分裂)。10。iii和iv heart sounds。疾驰的节奏,其诊断价值。11。有机收缩性心脏杂音:形成的机理,原因,听诊的位置,特征。12。有机舒张期杂音。原因,形成机制,听诊的位置,特征。13。功能性舒张性杂音,形成的原因和机制。14。功能收缩期杂音,形成的原因和机制。15。心心摩擦声音,胸膜炎和心肺杂音。16。动脉和静脉压。17。肺栓塞,诊所,诊断。18。确定方法,年龄规范,增加动脉和静脉压的诊断价值。心脏哮喘和肺水肿的综合征,诊断。 19。 急性血管功能不全(晕厥,休克)。 临床图片,诊断。 20。 慢性心力衰竭。 定义,N.D.Strazhesco,V.H.Vasilenko和NYHA分类的阶段。心脏哮喘和肺水肿的综合征,诊断。19。急性血管功能不全(晕厥,休克)。临床图片,诊断。20。慢性心力衰竭。定义,N.D.Strazhesco,V.H.Vasilenko和NYHA分类的阶段。
妊娠期高血压:诊断、血压目标……
先兆子痫 妊娠期高血压,妊娠 > 20 周,之前血压正常或有严重范围的高血压,此外还存在以下至少 1 项症状: • 蛋白尿(≥300 mg/24 小时尿液,或 PCR ≥0.3,或只有在没有其他定量方法的情况下试纸 2+) • 肾功能不全(肌酐 > 1.1 mg/dL 或在没有其他肾脏疾病的情况下血清肌酐浓度加倍) • 血小板减少(<100× 10 9 /L) • 肝功能受损(ALT/AST ≥ 2 倍正常上限) • 肺水肿 • 新发头痛或视力障碍(不是由于其他诊断)
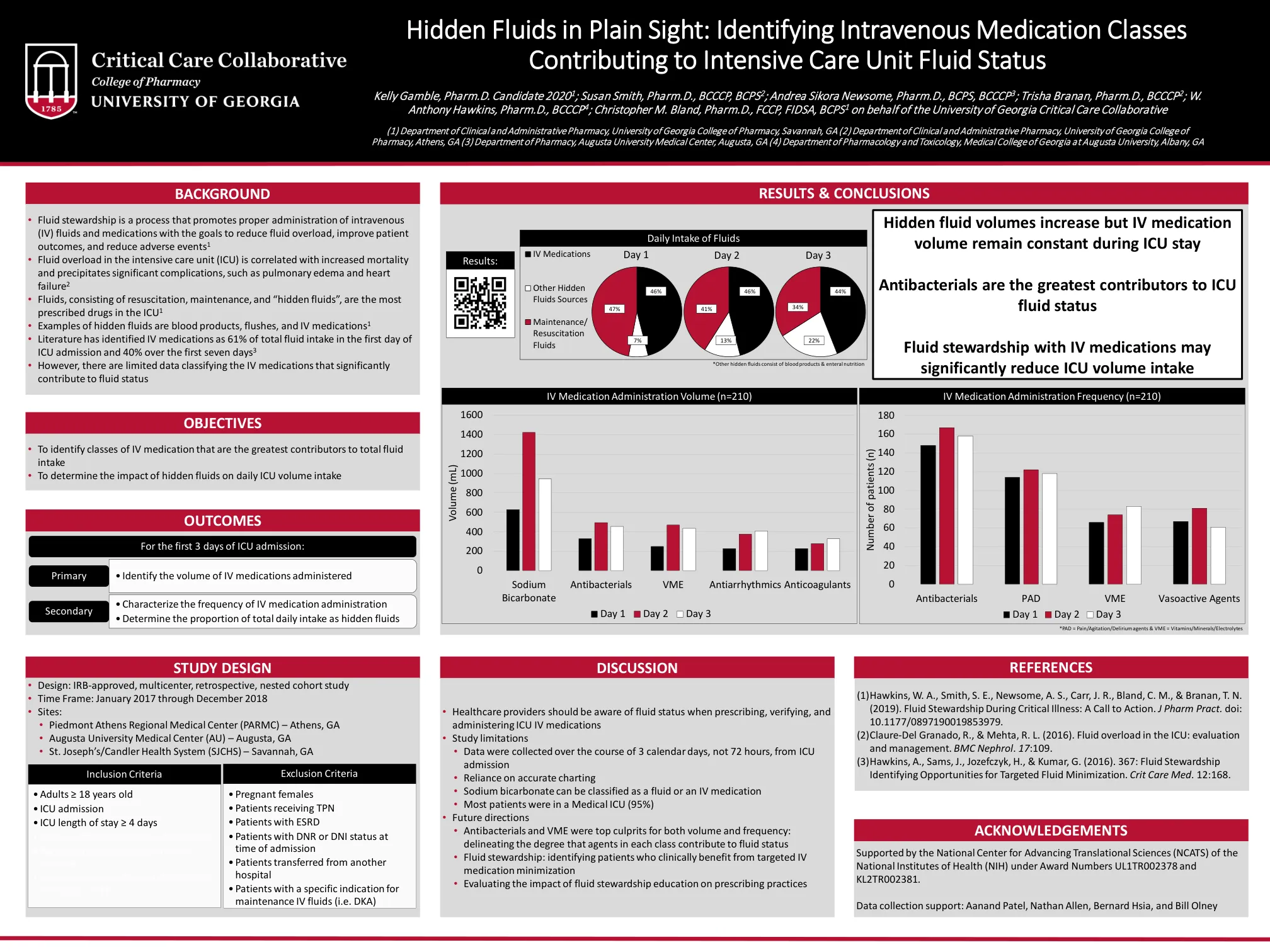
ICU 住院期间,隐性液体量增加,但静脉注射药物量保持不变 抗菌药物是 ICU 液体状态的最大因素
• 液体管理是一个促进正确管理静脉 (IV) 液体和药物的过程,目的是减少液体超负荷、改善患者预后和减少不良事件 1 • 重症监护病房 (ICU) 中的液体超负荷与死亡率增加有关,并会导致严重的并发症,例如肺水肿和心力衰竭 2 • 液体包括复苏液、维持液和“隐藏液体”,是 ICU 中最常用的处方药 1 • 隐藏液体的例子有血液制品、冲洗液和 IV 药物 1 • 文献显示,IV 药物占 ICU 入院第一天总液体摄入量的 61%,占前七天总液体摄入量的 40% 3 • 但是,对显著影响液体状态的 IV 药物进行分类的数据有限
2025 NHSN肺炎(PNEU)清单
•根据体征,症状和单个确定的胸部成像测试结果,与医疗保健相关的肺炎的诊断可能很清楚。因此,在没有潜在肺部或心脏病的患者中,并且只有一个成像测试可用时,如果成像发现是合格且确定的发现,则可以满足成像测试证据的要求。•在没有潜在疾病的患者中,如果有多个成像测试可用,则还必须评估串行成像测试结果(在7天的时间内),并且必须证明合格和确定的发现的持久性。•在潜在的肺或心脏病患者中(例如间质性肺部疾病,充血性心力衰竭等。),肺炎的诊断可能特别困难。例如,来自代偿充血性心力衰竭的肺水肿的成像发现可能会模拟肺炎的表现。因此,在潜在疾病的患者中,必须检查串行胸部成像测试结果(在7天的时间内),并且必须证明合格和确定的发现的持久性,以帮助将传染性与非感染性肺部过程分开。2。请注意,有许多描述肺炎成像外观的方法。示例包括但不限于“空间疾病”,“局灶性渗透”,“密度增加的斑点区域”。虽然也许不是被放射科医生专门描述为肺炎,但在适当的临床环境中,应认真将这些替代性描述性措辞视为潜在的积极发现。3。如果提供的结果,则没有记录结果,因为另一个问题(例如,肺水肿,慢性肺病),他们有资格满足肺炎的成像测试证据。脓性痰定义为含有≥25个嗜中性粒细胞的肺,支气管或气管的分泌物,每个低功率场≤10个鳞状上皮细胞(x100)。请参阅下表,如果您的实验室报告这些数据半量化或使用其他格式报告革兰氏染色或直接检查结果(例如,“许多WBC”或“少数鳞状上皮细胞”)。需要此实验室确认,因为纯度的书面临床描述是高度可变的。
心脏手术的贫血和结果
在这种情况下,最相关的研究之一是TRICC试验,4一项涉及838例舒适患者的随机临床试验(RCT)。这项研究涵盖了多样化的爆炸,血红蛋白水平<9 g.dl 1在入院后72小时内。这项开创性的工作挑战了当时有效的自由输血逻辑,比较了限制性输血臂(血红蛋白<7 g.dl 1)与自由臂(血红蛋白<10 g.dl 1)。在限制组中,心肌梗塞和急性肺水肿的发病率在统计学上较低。这项研究得出的结论是,除了心血管疾病患者的亚组死亡率外,一种更加易于的输血策略至少与重症患者的自由策略一样有效,甚至不优于自由策略。