XiaoMi-AI文件搜索系统
World File Search System处方信息重点 这些重点不包括安全有效地使用 EMBLAVEO 所需的所有信息。查看完整处方信息
警告和注意事项 • 超敏反应:接受 EMBLAVEO 治疗的患者中观察到超敏反应,包括皮疹、潮红和支气管痉挛。如果出现超敏反应,应立即停用 EMBLAVEO 并开始适当的药物治疗和/或支持治疗。(5.1) • 严重皮肤病:据报道,在接受骨髓移植且具有多种风险因素的患者中,使用氨曲南(EMBLAVEO 的一种成分)后,出现了中毒性表皮坏死松解症病例。如果出现严重皮肤反应,应停用 EMBLAVEO。(5.2) • 肝脏不良反应:在使用 EMBLAVEO 治疗期间观察到肝转氨酶升高。如果发现转氨酶升高,应考虑停用 EMBLAVEO(如有临床指征),并监测患者以观察任何相关临床和实验室发现是否得到解决。 (5.3)• 艰难梭菌相关性腹泻 (CDAD):几乎所有全身性抗菌药物(包括 EMBLAVEO)均报告有导致 CDAD 的现象。如出现腹泻,则进行评估。(5.4)
临床调试政策:用于难治性结节病的英夫利昔单抗(不包括神经性神经病)
将通过使用事先批准表来审查数据。将建立一个国家注册中心,以在英国胸腔社会的支持下对英夫利昔单抗治疗的临床结果进行整理数据,该学会已经拥有既定的肺结论注册表。必须及时,定期和准确的方式对通过此政策治疗的患者收集临床治疗和临床结果数据至关重要。此类数据至少应包括人口统计患者信息,治疗原因(即适用的资格标准),适用的标准的测量以及6个月治疗的临床结果(是否症状和/或标准已被缓解。这包括使用相关工具和评估,例如DAS,CSMI或KSQ的结果。所有针对难治性结节病的英夫利昔单抗开具的临床医生(不包括神经性疾病)必须确保满足任何其他数据收集要求,以进行相关的审计和评估。收集信息以告知未来的政策修订。
处方信息重点 这些重点不包括安全有效地使用 RALDESY TM 所需的所有信息。请参阅完整处方信息
• 直立性低血压和晕厥:警告患者低血压的风险和症状(5.4)。 • 出血风险增加:同时使用阿司匹林、非甾体抗炎药 (NSAID)、其他抗血小板药物、华法林和其他抗凝剂可能会增加这种风险(5.5)。 • 阴茎异常勃起:已报告阴茎勃起疼痛和长时间勃起以及阴茎异常勃起的病例。如果观察到阴茎勃起时间延长或阴茎异常勃起的体征和症状,应立即就医(5.6)。 • 躁狂或轻躁狂发作:筛查躁郁症并监测躁狂或轻躁狂(5.7)。 • 认知和运动障碍的可能性:有损害判断力、思维和运动技能的可能性。建议患者操作机器时要小心(5.9)。 • 闭角型青光眼:避免对未经治疗的解剖学窄角患者使用抗抑郁药,包括 RALDESY(5.10)。
蓝色优势政策的名称:实体瘤的射频消融,不包括肝肿瘤政策#:119最新评论日期:9月20日
1。安全有效; 2。不实验或研究*; 3。适当,包括适合该服务的持续时间和频率,就其是否为:•根据公认的医学实践标准提供诊断或治疗患者状况或改善畸形身体成员的功能; •在适合患者的医疗需求和状况的环境中提供; •由合格人员订购和提供; •符合但不超过患者的医疗需求的人; •至少与现有且可用的医学上适当替代方案一样有益。*在2000年9月19日或之后,有资格的临床试验服务的常规费用符合临床试验NCD的要求,Medicare认为是合理且必要的。提供者应向原始医疗保险收到与符合医疗保险要求的临床试验相关的涵盖服务(请参阅Medicare国家覆盖范围确定手册,第1章,第310条和Medicare索赔处理手册第32章,第69.0-69.11节)。
这些亮点不包括安全有效地使用Tosymra®所需的所有信息。请参阅Tosymra®的完整处方信息。 Tosymra®(Sumatriptan)鼻喷雾初始美国批准:1992
警告和预防措施心肌缺血/梗死和Prinzmetal的心绞痛:对具有多个心血管危险因素的患者进行心脏评估(5.1)心律失常:如果发生(5.2)胸部/喉咙/颈部/颈部/jaw疼痛,紧绷,压力,通常与Myare;评估高风险患者(5.3)脑出血,蛛网膜下腔出血和中风的患者的冠状动脉疾病:如果发生(5.4)胃肠道缺血和反应,胃肠道不连接,外围性血管反应(5)综合征:如果发生(5.7)血压增加:可能发生高血压危机(5.8) - 可能发生高敏性反应:血管性水肿和过敏反应(5.9)癫痫发作:谨慎使用癫痫患者或癫痫病或降低的癫痫发光(5.10)局部燃烧(5.10)
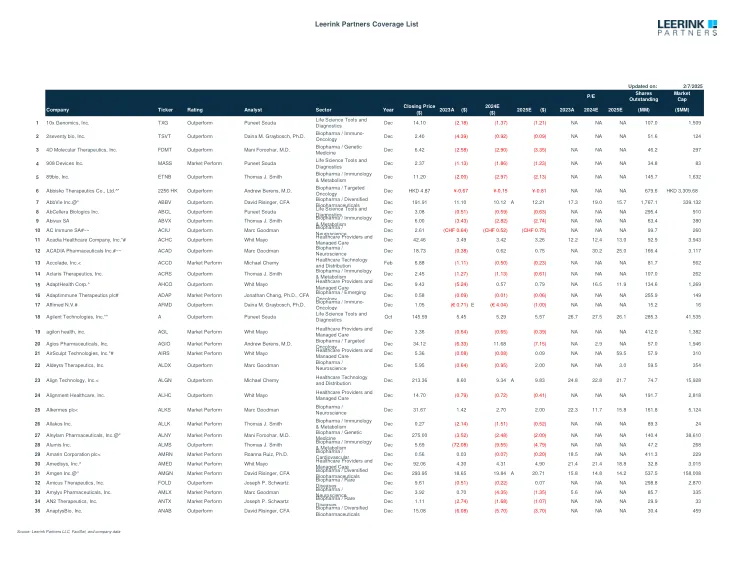
Leerink合作伙伴覆盖列表
注意:除非指出,否则GAAP提出; ^ EPS不包括1X项目和其他费用; + EPS不包括股票期权费用和其他股票费用; 〜操作EPS不包括1X项目和其他费用; *操作EPS不包括股票期权费用和其他费用; ^^ Pro Forma EPS不包括1X项目和其他费用; ** EPS不包括1个时间费用和无形资产的摊销; ## EPS不包括无形资产的摊销; #EPS IFRS; +++特许权使用费的EPS网; ~~~ EPS不包括股票补偿,交易费用和购买会计调整; @@ EPS不包括衍生工具的公允价值变化; 1x项目; *** adj。 EP不包括摊销,基于股票的补充和其他不反映核心操作的项目; *#*调整后的EPS包括RAC发布和谨慎税收优惠的影响; ^*^ 2Q19 EPS已针对IPO的影响进行了调整; ^^#core eps per aDr; ~~#EPS估计反映了核心EPS,不包括。 非凡的项目并反映IFRS重述,包括。 选项费用。 ; *#^ adj。 ebitda; ^**非IFR稀释EPS; ^*〜现金EPS1x项目; *** adj。EP不包括摊销,基于股票的补充和其他不反映核心操作的项目; *#*调整后的EPS包括RAC发布和谨慎税收优惠的影响; ^*^ 2Q19 EPS已针对IPO的影响进行了调整; ^^#core eps per aDr; ~~#EPS估计反映了核心EPS,不包括。非凡的项目并反映IFRS重述,包括。选项费用。; *#^ adj。ebitda; ^**非IFR稀释EPS; ^*〜现金EPS
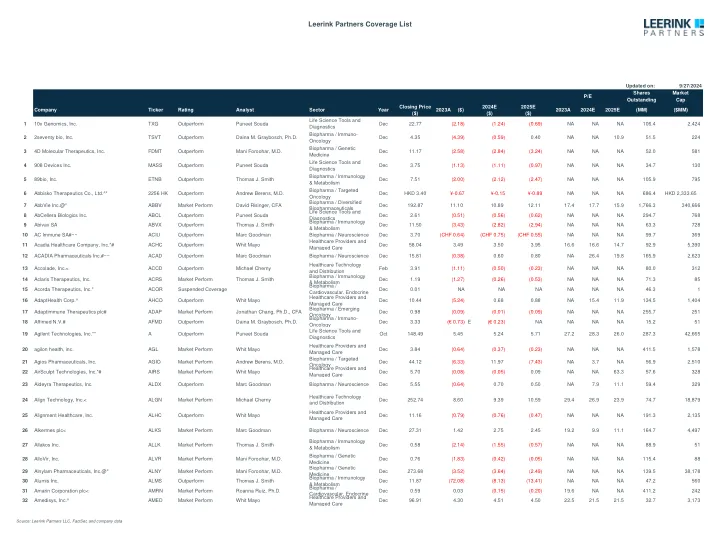
Leerink合作伙伴覆盖列表
注意:除非指出,否则GAAP提出; ^ EPS不包括1X项目和其他费用; + EPS不包括股票期权费用和其他股票费用; 〜操作EPS不包括1X项目和其他费用; *操作EPS不包括股票期权费用和其他费用; ^^ Pro Forma EPS不包括1X项目和其他费用; ** EPS不包括1个时间费用和无形资产的摊销; ## EPS不包括无形资产的摊销; #EPS IFRS; +++特许权使用费的EPS网; ~~~ EPS不包括股票补偿,交易费用和购买会计调整; @@ EPS不包括衍生工具的公允价值变化; 1x项目; *** adj。 EP不包括摊销,基于股票的补充和其他不反映核心操作的项目; *#*调整后的EPS包括RAC发布和谨慎税收优惠的影响; ^*^ 2Q19 EPS已针对IPO的影响进行了调整; ^^#core eps per aDr; ~~#EPS估计反映了核心EPS,不包括。 非凡的项目并反映IFRS重述,包括。 选项费用。 ; *#^ adj。 ebitda; ^**非IFR稀释EPS; ^*〜现金EPS1x项目; *** adj。EP不包括摊销,基于股票的补充和其他不反映核心操作的项目; *#*调整后的EPS包括RAC发布和谨慎税收优惠的影响; ^*^ 2Q19 EPS已针对IPO的影响进行了调整; ^^#core eps per aDr; ~~#EPS估计反映了核心EPS,不包括。非凡的项目并反映IFRS重述,包括。选项费用。; *#^ adj。ebitda; ^**非IFR稀释EPS; ^*〜现金EPS
16 bit 模数转换器TM7706 - NET
注释: 1.B 级温度范围为 -40 ℃ ~+85 ℃。 2.这些数据是按最初设计的产品发布的。 3.一次校准实际上是一次转换,因此这些误差就是表 1 和表 3 所示转换噪声的阶数。这 适用于在期望的温度下校准后。 4.任何温度条件下的重新校准将会除去这些漂移误差。 5.正满标度误差包括零标度误差 ( Zero-Scale Error )(单极性偏移误差或双极性零误 差),且既适用于单极性输入范围又适用于双极性输入范围。 6.满标度漂移包括零标度漂移 (单极性偏移漂移或双极性零漂移)且适用于单极性及 双极性输入范围。 7.增益误差不包括零标度误差,它被计算为满标度误差——对单极性范围为单极性偏移 误差,而对双极性范围为满标度误差——双极性零误差。 8.增益误差漂移不包括单极性偏移漂移和单极性零漂移。当只完成了零标度校准时,增 益误差实际上是器件的漂移量。 9.共模电压范围:模拟输入电压不超过 V DD +30mV ,不低于 GND-30mV 。电压低于 GND-200mV 时,器件功能有效,但在高温时漏电流将增加。 10.这里给出的 AIN ( + )端的模拟输入电压范围,对 TM7706 而言是指 COMMON 输入 端。输入模拟电压不应超过 V DD +30mV, 不应低于 GND-30mV 。 GND-200mV 的输入 电压也可采用,但高温时漏电流将增加。 11.VREF=REF IN ( + )- REF IN ( - )。 12.只有当加载一个 CMOS 负载时,这些逻辑输出电平才适用于 MCLK OUT 。 13.+25 ℃时测试样品,以保证一致性。 14.校准后,如果模拟输入超过正满标度 , 转换器将输出全 1, 如果模拟输入低于负满标度, 将输出全 0 。 15.在模拟输入端所加校准电压的极限不应超过 V DD +30mV 或负于 GND - 30mV 。 16.当用晶体或陶瓷谐振器作为器件的时钟源时 (通过 MCLK 引脚 ), V DD 电流和功耗 随晶体和谐振器的类型而变化 (见“时钟和振荡器电路”部分)。 17.在等待模式下,外部的主时钟继续运行, 5V 电压时等待电流增加到 150 μ A , 3V 电 压时增加到 75 μ A 。当用晶体或陶瓷谐振器作为器件的时钟源时,内部振荡器在等待 模式下继续运行,电源电流功耗随晶体和谐振器的类型而变化 (参看“等待模式” 一节)。 18.在直流状态测量,适用于选定的通频带。 50Hz 时, PSRR 超过 120dB (滤波器陷波 为 25Hz 或 50Hz )。 60Hz 时, PSRR 超过 120dB (滤波器陷波为 20Hz 或 60Hz )。 19.PSRR 由增益和 V DD 决定,如下:
ifp Plan Brochure Py25(Georgia)
2025年,在TX(不包括非精英EPO青铜计划),纽约州(不包括标准银,青铜和安全计划),FL(不包括HSA和安全计划),AZ(不包括安全计划),GA(不包括HSA和安全计划),不包括安全计划,不包括安全计划,不包括安全计划)。奥斯卡初级保健提供者由奥斯卡医疗集团(Oscar Medical Group),而不是奥斯卡保险公司(Oscar Insurance Company)或其保险计划分支机构雇用。奥斯卡初级保健仅适用于18岁及以上的成员。处方,访问和服务可能会受到裁量权的限制,而奥斯卡初级保健不打算与另一项初级保健咨询一起使用。与您的虚拟访问结合使用的奥斯卡式护理访问可能会有共付额。由于医疗许可法,您必须在虚拟访问时处于家乡状态。