XiaoMi-AI文件搜索系统
World File Search Systempsilocybin生物合成的网关脱羧酶的表征
psilocybin的细胞生物合成和体内或体外的生物催化途径均由L-色氨酸脱羧酶PSID启动。这种网关脱羧酶是原发性和次级代谢之间的界面,通常依赖于5'-磷酸吡啶量(PLP)作为假体组。[9]相反,PSID对于二次代谢是不寻常的,因为它与磷脂酰丝氨酸脱羧基盒(PSDS)有关。这些是独立于PLP的酶,可以自动裂解C末端部分,称为α链,从蛋白酶中脱离。[10]在裂解过程中,α链将其N末端丝氨酸转化为曲武(Pyr)残基,后者是内在的假体组。切割后,酶具有催化能力,可以在共价结合的PYR的α-碳碳碳与L -TRP底物的主要胺之间形成Schiff碱。[10]
RIPK1和RIPK3抑制剂:针对炎症的潜在武器治疗糖尿病并发症
糖尿病是一种代谢疾病,其特征是由于多种病因因素而引起的慢性高血糖。长期代谢应激会诱导有害的炎症,导致慢性并发症,主要是糖尿病眼科,糖尿病性心血管并发症和糖尿病性肾病。由于糖尿病并发症是残疾和死亡的主要原因之一,在组合疗法中使用抗肿瘤的糖尿病正在增加。对靶向炎症途径的显着调节剂的兴趣越来越大,特别是受体互动丝氨酸/苏氨酸激酶-1(RIPK1)(RIPK1)和受体互动丝氨酸/苏氨酸 - 激酶-3(RIPK3)(RIPK3),作为用于治疗偶然性疾病的药物靶标。在这篇综述中,我们旨在提供有关RIPK1和RIPK3的作用和药物开发机制的最新摘要,这些研究在慢性炎症和免疫力中至关重要,这些研究与糖尿病并发症有关,与糖尿病并发症有关,这些并发可能是对选择性RIPK1和RIPK1的潜在的,并且是RIPK1的潜在,并且并发症。
回顾底物辅助催化:分子基础和生物学意义
底物辅助催化〜囊!是底物中的官能团有助于酶催化的过程。已证明了三种主要酶类别的代表:丝氨酸蛋白酶,GTPase和II型限制性核酸内切酶,以及溶菌酶和己糖1-磷酸尿液尿溶液转移酶。此外,对于许多其他酶,对SAC进行了基于结构的预测。SAC的例子包括自然存在的酶,例如II型限制性核酸内切酶以及包括丝氨酸蛋白酶的工程酶。在后一种情况下,底物的官能团可以代替被位于位置的诱变代替的催化残基。从蛋白质工程的角度来看,SAC提供了一种策略,以极大地改变酶底物的特异性甚至催化的反应。从生物学角度来看,SAC对某些酶的活性做出了重大贡献,并且可能代表催化剂进化中的功能性中间体。本综述着重于SAC的工程酶特异性和活性的进步,以及该现象的生物学意义。
让微生物活动起来的简单测试可能会促进寻找外星生命的努力
柏林工业大学研究员马克斯·里克莱斯说:“我们测试了三种微生物——两种细菌和一种古细菌——发现它们都向一种名为 L-丝氨酸的化学物质移动。这种运动被称为趋化性,可能是生命存在的有力指标,可以指导未来在火星或其他星球上寻找生物的太空任务。”
Q1 HCPCS I级和II级更新(2024年1月1日)
C1酯酶抑制剂是人血的正常成分,是丝氨酸蛋白酶抑制剂(SERPINS)之一。C1酯酶抑制剂的主要功能是调节补体和内在凝结(接触系统)途径的激活。C1抑制剂还调节纤溶系统。这些系统的调节是通过蛋白酶和抑制剂之间的复合物形成进行的,从而导致C1抑制剂的消耗和消耗。
血小板传播-1介导Rho-激酶抑制剂...
图7细胞运动分析显示了TSP1抑制剂和siRNA敲低的作用。间隙打开区域的呈现为第0天间隙宽度的百分比。(a)以不同浓度的LSKL或SLLK处理(每组n = 3)。(b)用TSP1 siRNA和NC炒对照siRNA转染(每组n = 3)。(c)1 µM Y39983与5 µM LSKL或SLLK(每组n = 4)的处理。(d)1 µM Y39983的处理与100 pmol的对照或TSP1 siRNA(每组n = 4)。(E)在1 µM Y39983处理中与5 µM LSKL或SLLK的治疗中的Transwell迁移2天(每组n = 3)。(f)在1 µM Y39983与100 pmol的对照或TSP1 siRNA的处理中,Transwell迁移2天(每组n = 3)。sllk:控制肽; LSKL:TSP1阻断肽。数据表示平均值±SEM。lskl,亮氨酸 - 丝氨酸 - 赖氨酸 - 亮氨酸; NC,阴性对照; NS,没有统计学意义; siRNA,小干扰RNA; SLLK,丝氨酸 - 亮氨酸 - 亮氨酸 - 赖氨酸; TSP1,血小板传播-1。**p≤0.01; *p≤0.05(Student's T -Test)
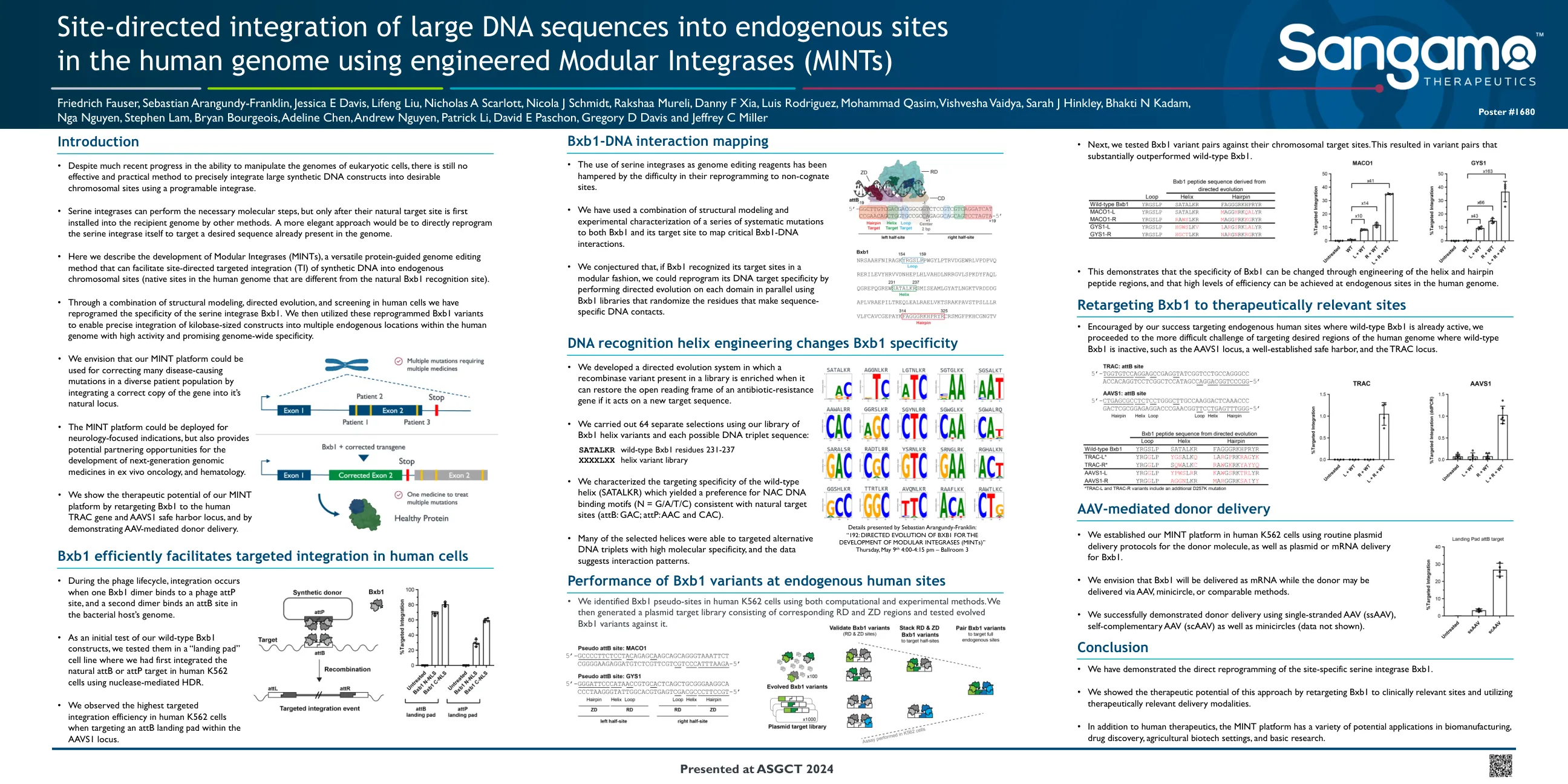
介绍DNA识别螺旋工程改变...
• 通过结构建模、定向进化和人类细胞筛选相结合的方法,我们重新编程了丝氨酸整合酶 Bxb1 的特异性。然后,我们利用这些重新编程的 Bxb1 变体,将千碱基大小的构建体精确整合到人类基因组内的多个内源位置,具有高活性和有希望的全基因组特异性。DNA 识别螺旋工程改变 Bxb1 特异性
发现和表征丝氨酸 - 硫代激酶细胞周期蛋白依赖激酶样5(CDKL5)的特异性抑制剂(CDKL5)在海马CA1生理中表现出作用
发现和表征丝氨酸 - 硫代激酶细胞周期蛋白依赖激酶样5(CDKL5)的特定抑制剂(CDKL5)在海马CA1生理学中的作用Anna Castano*科罗拉多大学医学院,科罗拉多州Aurora,Co anna.castano and brinase ins naberatory* coinschud silgaux silveest and karga silvester*弗朗西斯·克里克研究所(Francis Crick InstituteWells Structural Genomics Consortium, UNC Eshelman School of Pharmacy, University of North Carolina at Chapel Hill, Chapel Hill, North Carolina, 27599, United States of America carrow.i.wells@gsk.com Jennifer L. Sanderson Department of Pharmacology, University of Colorado School of Medicine, Aurora, CO JENNIFER.SANDERSON@CUANSCHUTZ.EDU Carla A. Ferrer结构基因组学联盟,UNC Eshelman药学院,北卡罗来纳大学,北卡罗来纳州教堂山的教堂山,27599年,美利坚合众国calafe2@hotmail.2@hotmail.com han wee ong结构性基因组联盟,北卡罗莱纳州北卡罗莱纳州北卡罗莱纳州北卡罗莱纳州北卡罗莱纳州北卡罗莱纳州北卡罗莱纳州北卡罗莱纳州北卡罗莱纳州,Chapel山,Chapel 9. onghw@live.unc.unc.edu yi liang结构基因组学联盟,UNC Eshelman药学院,北卡罗来纳大学北卡罗来纳州教堂山的北卡罗来纳大学,北卡罗莱纳州教堂山,27599年,美国美国诺夫德·理查森(William Richardson)的美国诺夫尔·理查森(William Richards)医学界,美国纳菲尔德·诺夫(Oxford),美国诺夫·理查森(William Richardson) william.richardson95@outlook.com乔西·A·西尔瓦洛里(Josie A.卡罗来纳州,27599年,美利坚合众国。
合成,在黄酮衍生物的硅和结构见解中,作为新的竞争性登革热NS2B/NS3蛋白酶抑制剂
摘要:登革热病毒(DENV)是一种属于Flaviviridae家族和Flavivivirus属的单链RNA病毒。登革热病毒感染可引起登革热出血热(DD),可能导致登革热出血热(DHF)。这项研究的主要目的是合成2'-甲氧基黄酮(2F)及其衍生物(TF2),并预测这些分子作为登革热病毒DENV-2 NS2B/NS3丝氨酸蛋白酶的结合取向。合成是使用搅拌方法进行的,它是从2'-羟基-2-甲氧基酮和过氧化氢作为起始材料开始的。2'-甲氧基黄酮(2F)以白色粉末的形式获得,产量为71.85%。此外,使用反流方法反应的1-溴-3-氯丙烷的化合物2F,以获得82.32%的白色晶体的形式获得化合物TF2。使用光谱分析i证实了合成化合物的分子结构。 e。 UV,FT-IR,1 H-NMR和13 C-NMR。基于分子对接和密度功能理论(DFT),证明化合物TF2可以用作潜在的登革热DEN2 NS2B/NS3丝氨酸蛋白酶蛋白酶抑制剂。这种策略是发现新药的早期阶段,然后可以用作登革热病毒抑制剂。