XiaoMi-AI文件搜索系统
World File Search System利用神经特征增强任务 fMRI 个体差异研究
本研究由 K99AA030808 (DAAB) 和 R01DA54750 (RB) 资助。其他资助包括:AJG (DGE-213989)、SEP (F31AA029934)、ASH (K01AA030083)、RB (R21AA027827、U01DA055367)。本研究的数据由青少年大脑认知发展 (ABCD) 研究提供,该研究由美国国立卫生研究院和其他联邦合作伙伴颁发的 U01DA041022、U01DA041025、U01DA041028、U01DA041048、U01DA041089、U01DA041093、U01DA041106、U01DA041117、U01DA041120、U01DA041134、U01DA041148、U01DA041156、U01DA041174、U24DA041123 和 U24DA041147 奖项资助 (https://abcdstudy.org/federal-partners.html)。参与站点列表和研究调查员的完整列表可在 https://abcdstudy.org/consortium_members/ 上找到。ABCD 联盟调查员设计并实施了这项研究和/或提供了数据,但不一定参与了本报告的分析或撰写。本稿件反映的是作者的观点,可能不反映 NIH 或 ABCD 联盟调查员的意见或观点。
评估西班牙偏头痛的个体的饮食习惯:探索性观察性横断面试验研究
摘要:背景/目标:已提出饮食习惯是偏头痛的潜在治疗方法;然而,缺乏支持公司建议的科学证据。具体来说,尚未研究居住在西班牙偏头痛的饮食习惯。因此,本研究旨在评估其饮食模式,并根据偏头痛发作的频率或与偏头痛相关的残疾程度来研究这些习惯如何变化。方法:对西班牙诊断为偏头痛的260名(18-64岁)进行了探索性,观察性,横断面试验研究。饮食,生活方式和偏头痛特征的数据是通过在线问卷收集的,该问卷包括食物频率问卷,并询问有关饮食,生活方式以及与偏头痛有关的不同方面的看法。使用Kruskal – Wallis检验分析统计差异,然后使用JASP进行DUNN的事后检验。恢复:植物性食品的消费低于Aesan的建议。在不同的Mi-Graine攻击频率或与偏头痛相关的残疾水平的食物食物消耗方面没有观察到差异。慢性偏头痛组和严重的残疾人组都表现出一些被认为是偏头痛触发因素(例如巧克力,腌制奶酪,腌制肉和含酒精饮料)的食物的差异。此外,患有偏头痛的人的咖啡因比患有慢性偏头痛的人多得多。因此,必须进一步研究饮食在偏头痛管理中的作用。结论:尚不清楚避免饮食偏头痛触发因素是受某些食物化合物的生物学作用还是受饮食感知和毫无根据的信念影响的驱动。
合成生物学对低纤维摄入个体的肠道微生物组的有益作用:双盲,随机对照试验的次级分析
1营养与食品科学研究所,营养与微生物群,波恩大学,53115 BONN,德国2 BONN 2 BONNANY 2 BONNY HOSPICY HOSPICY BONN基因组统计与生物信息学研究所,德国53127 BONN,德国BONN,BONN,BONN,BONN,BONN,BONN,BONN,BONN,BONN,BONN,BONN,BONN,BONNY 3 3 3波恩大学,德国53115 BONN 53115 BONN 5,波恩大学,波恩大学,53113 BONN,德国6里昂神经科学研究中心(CRNL),中心,国家de la Recherche Scientifique(CNRS),Institut de lasanté等人(Inserm lliemer),法国里昂,里昂7欧洲研究所,法国77300年,法国77300,87300 Control Interoception-Intervistion团队,巴黎脑研究所(ICM),法国75013,法国巴黎 *通信1营养与食品科学研究所,营养与微生物群,波恩大学,53115 BONN,德国2 BONN 2 BONNANY 2 BONNY HOSPICY HOSPICY BONN基因组统计与生物信息学研究所,德国53127 BONN,德国BONN,BONN,BONN,BONN,BONN,BONN,BONN,BONN,BONN,BONN,BONN,BONN,BONNY 3 3 3波恩大学,德国53115 BONN 53115 BONN 5,波恩大学,波恩大学,53113 BONN,德国6里昂神经科学研究中心(CRNL),中心,国家de la Recherche Scientifique(CNRS),Institut de lasanté等人(Inserm lliemer),法国里昂,里昂7欧洲研究所,法国77300年,法国77300,87300 Control Interoception-Intervistion团队,巴黎脑研究所(ICM),法国75013,法国巴黎 *通信
初步现实世界证据表明接种 BNT162b2 疫苗的个体病毒载量较低
4。M.Voysey,S.A。Costa Clemens,S.A。Madhi,Ly Weckx,PM Folegatti,PK Aley,PK Aley,BJ Angus,V。Baillie,Sl Barnabas,Sl Barnabas,Qe Bhorat,S。Beebe,S。Beebe,S。Beebe,S。 ,Sn Faust,S。Feng,DM Ferreira,A。Finn,E。Galiza,Al Goodman,CM Green,CA Green,M。Greenland,M。Greenland,C。Hill,Hc Hill,I。Hirsch,A。Izu,A。Izu,D。Jenkin,S。Kerridge,A。Koen,A。Koen,A. Regor,Y。FarooqMujadidi,A。Nana,SD Payadachee,DJ Phillips,A。Pittella,E。Plested,KM Pollock,Mn Ramasamy,H。Robinson,H。Robinson,Av Schwarz Bold,A。Smith,A。Smith,R。Md,歌曲。
基于靶向定量蛋白质组学的小肠药物转运蛋白和代谢酶的个体发育 Kiss, M.; Mbasu, Richard; Nicolai, J
儿童大部分药物为口服给药,但各年龄段儿童小肠药物代谢酶(DME)和药物转运体(DT)的蛋白质丰度信息仍不明确,这阻碍了儿童精准用药。为了探索 DME 和 DT 的年龄相关差异,收集了儿童和成人空肠和回肠手术剩余的肠组织,并通过靶向定量蛋白质组学分析了顶端钠 - 胆汁酸转运蛋白、乳腺癌耐药蛋白(BCRP)、单羧酸转运蛋白 1(MCT1)、多药耐药蛋白 1(MDR1)、多药耐药相关蛋白(MRP)2、MRP3、有机阴离子转运多肽 2B1、有机阳离子转运蛋白 1、肽转运蛋白 1(PEPT1)、CYP2C19、CYP3A4、CYP3A5、UDP 葡萄糖醛酸转移酶(UGT)1A1、UGT1A10 和 UGT2B7。分析了 58 名儿童(48 条回肠、10 条空肠,年龄范围:8 周至 17 岁)和 16 名成人(8 条回肠、8 条空肠)的样本。比较年龄组时,成人回肠中的 BCRP、MDR1、PEPT1 和 UGT1A1 丰度明显高于儿童回肠。空肠 BCRP、MRP2、UGT1A1 和 CYP3A4 丰度在
在患有饮酒障碍的个体中短率有氧运动的神经内分泌效应:一项准实验研究
一半的慢性酒精人口通常在脱核中心进行广泛治疗后复发。这种渴望是由于下丘脑 - 垂体 - 肾上腺,下丘脑 - 垂体 - 核能和下丘脑 - 垂体 - 甲状腺甲状腺轴的释放降低所致。运动对某些神经内分泌轴有积极影响,释放了皮质营养素,皮质醇,催产素和加压素。因此,有必要研究急性饮酒型急性和焦虑的人在脱颖而出的计划中的额外好处。这项研究旨在比较催产素,皮质醇和加压素的血液水平,并将这些因素定期进行短折叠有氧运动的个体的渴望和焦虑以及在酒精降低中心中不进行任何类型运动的人的影响。
英国的大麻使用:医学和休闲大麻用户的个体差异的定量比较
将可再生能源纳入全球能源组合中已成为解决能源需求并确保能源部门脱碳的可行解决方案之一。然而,它们的扩散面临着与决策,优化和设计复杂性有关的各种挑战,这些挑战削减了各个学科。因此,过渡到可再生能源是一个跨学科的主题,融合了各种领域的专业知识,包括工程,环境科学,经济学,政治和社会科学。本研究对跨学科方法进行了综述,以通过可持续设计加速混合可再生能源系统。审查从讨论可持续设计原则的讨论开始,重点是生命周期评估,模块化和弹性,以提高混合可再生能源系统(HRES)效率和适应性。接下来,该研究调查了用于HRES大小的各种优化技术,包括线性编程和元启发式方法。此外,该研究回顾了可用于根据多个属性从优化技术获得的最佳HRE的评估和优先级的多标准方法。此外,研究还研究了如何使用空间优化来改善HRE的采用。最后,该研究提出了一个跨学科框架,该框架综合了各种学科,可以帮助加速采用混合可再生能源系统。预计这种方法将为HRES技术的广泛采用提供强大的方法。
左旋多巴诱导的非周期性爆发动力学变化与帕金森病的个体临床改善有关
1. 艾克斯·马赛大学,CNRS,INT,德拉蒂莫内神经科学研究所,13005,马赛,法国。 2. 艾克斯-马赛大学、INSERM、INS、系统神经科学研究所,13005,马赛,法国 3. 中央地中海学院,13013,马赛,法国。 4. APHM,马赛大学医院,蒂莫内医院神经病学和运动障碍科,13005,法国。 5. 斯特拉斯堡大学神经科学认知与适应性实验室,67000 斯特拉斯堡,法国。 6. 罗马生物医学大学校园工程系非线性物理和数学模型组,意大利 00128。 7. 外科癫痫病科、功能性和立体定向神经外科,蒂莫内大学医院,13005,马赛,法国。8. 艾克斯马赛大学,UMR INSERM 1106,功能性神经外科系,13005,马赛,法国。¡ 资深作者 * 通讯作者:hasnae.agouram@univ-amu.fr,pierpaolo.sorrentino@univ-amu.fr
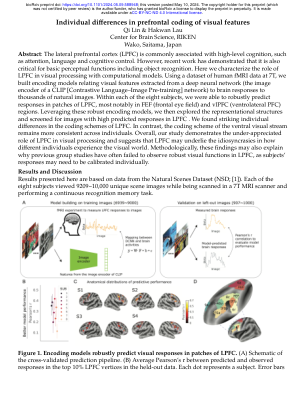
视觉特征前额编码的个体差异
摘要:外侧前额叶皮层 (LPFC) 通常与高级认知有关,例如注意力、语言和认知控制。然而,最近的研究表明,它对于包括物体识别在内的基本感知功能也至关重要。在这里,我们用计算模型描述了 LPFC 在视觉处理中的作用。使用 7T 的人类 fMRI 数据数据集,我们建立了编码模型,将从深度神经网络(CLIP [对比语言-图像预训练] 网络的图像编码器)中提取的视觉特征与大脑对数千张自然图像的反应联系起来。在八个受试者中,我们能够稳健地预测 LPFC 斑块中的反应,最明显的是 FEF(额叶眼场)和 vlPFC(腹外侧 PFC)区域。利用这些强大的编码模型,我们随后探索了表征结构并筛选了 LPFC 中具有高预测反应的图像。我们发现 LPFC 的编码方案存在显著的个体差异。相比之下,腹侧视觉流的编码方案在个体之间保持更一致。总体而言,我们的研究证明了 LPFC 在视觉处理中的作用未被充分重视,并表明 LPFC 可能是不同个体体验视觉世界的独特之处的基础。从方法论上讲,这些发现也可能解释了为什么以前的团体研究往往未能观察到 LPFC 中强大的视觉功能,因为受试者的反应可能需要单独校准。
5至17岁的患有先前SARS-COV-2感染的个体的疫苗有效性:恢复项目的基于EHR的基于EHR的目标试验仿真研究
Jiajie Chen, PhD 1,2* , Yuqing Lei, MS 1,2* , Qiong Wu, PhD 1,2,4 , Ting Zhou, MD, PhD 1,2 , Bingyu Zhang, MS 1,3 , Michael J. Becich, MD, PhD 6 , Yuriy Bisyuk, MD, PhD, DSc 7 , Saul Blecker, MD, MHS 8 , Elizabeth A. Chrischilles,博士9,Dimitri A. Christakis,医学博士,MPH 10,Lindsay G. Cowell,MS,MS,PhD 11,Mollie R. Cummins,PhD,RN,RN,Faan 12,Soledad A. Fernandez,Phd 13