XiaoMi-AI文件搜索系统
World File Search System肠脑串扰 - 印第安纳大学印第安纳波利斯分校 ScholarWorks
坏死性小肠结肠炎 (NEC) 是一种多因素致病的严重疾病,会影响早产儿的肠道,导致高发病率和死亡率。幸存的婴儿会面临多种长期后遗症,包括神经发育障碍 (NDI)——包括认知和社会心理缺陷以及运动、视力和听力障碍。肠脑轴 (GBA) 稳态的改变与 NEC 的发病机制和 NDI 的发展有关。GBA 上的串扰表明微生物失调和随后的肠道损伤可引发全身性炎症,随后是具有多条通路的致病信号级联,最终通向大脑。这些信号到达大脑并激活大脑中的炎症级联,导致白质损伤、髓鞘形成受损、头部生长延迟以及最终的下游 NDI。本综述的目的是总结 NEC 中观察到的 NDI,讨论有关 GBA 的已知信息,探索 NEC 环境中 GBA 与围产期脑损伤之间的关系,最后强调现有的可能治疗方法的研究,以帮助防止这些有害后果。
肠道微生物群和宿主免疫之间的串扰
摘要:肠道微生物及其代谢产物积极参与宿主免疫的发展和调节,这可能会影响疾病易感性。在此,我们回顾了肠道微生物群 - 免疫轴的最新研究进步。我们详细讨论了肠道微生物群是如何成为新生儿免疫发育的转化点,如新发现的典型,例如在子宫肠道代谢组和断奶反应中,例如母体印记,例如母体印记。我们描述了肠道菌群如何塑造先天性和适应性免疫,重点是代谢物短链脂肪酸和二胆酸。我们还全面描述了微生物群 - 免疫轴的破坏如何导致免疫介导的疾病,例如胃肠道感染,炎症性肠道疾病,心脏内代谢性疾病,心血管疾病,糖尿病,糖尿病,糖尿病和高度疾病,自动育种,自动繁殖(例如心脏血管疾病)高敏性(例如哮喘和过敏),心理疾病(例如焦虑症)和癌症(例如结肠直肠和肝癌)。我们进一步涵盖了粪便微生物群移植,益生菌,益生元和饮食多酚在重塑肠道菌群及其治疗潜力中的作用。继续,我们研究了肠道菌群如何调节免疫疗法,包括免疫检查点抑制剂,JAK抑制剂和抗TNF疗法。我们最后提到了宏基因组学,无菌模型和微生物群的当前挑战,以对肠道微生物群如何调节免疫力有基本的了解。总的来说,这篇综述提出了从微生物组靶向干预措施的角度改善免疫疗法的效率。
探索胃肠道肿瘤中免疫系统与遗传学之间的动态串扰
摘要:胃肠道肿瘤(GIST)代表了癌基因成瘾的范式模型。尽管突变状态对临床结果产生了众所周知的影响,但我们仍需要将知识扩展到影响GIST患者影响行为异质性异质性的其他因素。越来越多的研究表明,肿瘤微环境(TME)主要由肿瘤相关的巨噬细胞(TAMS)和淋巴细胞(TILS)和基质分化(SD)人群,对预后和对治疗的反应具有显着影响。有趣的是,即使当前对免疫反应在这种情况下的作用的了解仍然有限,但最近的临床前和临床数据强调了TME在GIST中的相关性,在不久的将来对临床实践的可能影响。此外,免疫检查点的表达(例如PD-L1,PD-1和CTLA-4)及其与GIST中的临床表型的关系正在成为潜在的预后生物标志物。展望未来,这些变量与要点的潜在肿瘤微环境有关,尽管仅限于仍在努力的试验,可能会导致潜在的免疫疗法使用,或者在晚期TKI-Cractory GIST中单独或与靶向治疗结合使用。本综述旨在加深对突变状态与要点免疫微环境之间潜在联系的理解。
人肺肿瘤衍生细胞模型中蛋白激酶 AKT 和 ERK1/2 之间的串扰
毫无疑问,细胞信号操控是抗癌治疗的关键策略。此外,细胞状态决定药物反应。因此,建立细胞状态和治疗敏感性之间的关系对于癌症疗法的发展至关重要。在个性化医疗时代,使用患者来源的离体细胞模型是将关键研究成果转化为临床应用的一种有前途的方法。在这里,我们专注于细胞对抗癌治疗耐药性的非致癌基因依赖性。使用一组具有各种干细胞和 EMT 相关标志物、不同程度的 ERK1/2 和 AKT 磷酸化以及对抗癌治疗反应的患者肺肿瘤衍生细胞系研究了对 MEK/ERK 和 PI3K/AKT 通路抑制剂(关键细胞功能调节剂)的反应信号相关机制。研究激酶之间的相互作用是我们研究的目标。尽管 MEK/ERK 和 PI3K/AKT 相互作用被认为是细胞系特异性的,其中致癌突变起着决定性作用,但我们证明了所有研究的细胞系中 MEK/ERK 和 PI3K/AKT 信号通路之间存在负反馈回路,无论基因型和表型差异如何。我们的研究表明,各种不同的 ERK 信号抑制剂(selumetinib、trametinib 和 SCH772984)可增加 AKT 磷酸化,相反,AKT 抑制剂(capivasertib、idelalisib 和 AKT 抑制剂 VIII)可增加对照细胞和顺铂治疗细胞中的 ERK 磷酸化。然而,激酶之间的相互作用取决于细胞状态。 ERK 和 AKT 之间的反馈被局部粘连激酶抑制剂 PF573228 减弱,并且在悬浮生长的细胞中也是如此,这表明细胞外接触在调节激酶之间的串扰方面可能发挥着作用。此外,研究表明,MEK/ERK 和 PI3K/AKT 信号通路之间的相互作用可能取决于化疗刺激的强度。该研究强调了抗癌治疗期间细胞的空间位置和治疗强度的重要性。
利用环形涡旋光束和聚焦镜减轻自由空间光通信中轨道角动量模式的串扰
携带OAM的涡旋光束由于其广泛的应用而引起了人们的广泛关注,例如光学操控与捕获[1]、成像[2]、量子纠缠[3]、自由空间光(FSO)通信[4]等等。特别地,那些具有相互正交特性的光束已被用于FSO通信中的复用/解复用,以增加容量和频谱效率[5,6]。然而,基于OAM复用/解复用的FSO通信面临的主要挑战是大气湍流的干扰。当激光束在大气中传播时,由于湍流引起折射率的随机波动,一个OAM态的能量将分散到相邻态[7-10]。这种现象称为OAM模式的串扰。显然,OAM模式间的串扰会影响通信质量,严重的串扰甚至会导致通信失败。在之前的研究中,人们采用自适应光学来补偿湍流大气中光束的OAM[11,12],但自适应光学系统非常复杂。此外,重构
共价 RNA 修饰及其与植物表观遗传过程的出芽串扰
摘要 我们最近认识到植物中多种 RNA 类经历动态共价化学修饰(或表观转录组标记),这为基因表达调控的潜在分子机制提供了新的见解。相比之下,由 DNA 和组蛋白的可遗传修饰组成的表观遗传标记已在植物中得到广泛研究,它们对植物基因表达的影响已得到充分证实。基于我们对植物表观转录组和表观基因组的不断增长的了解,探索这两个调控层如何相互融合以复杂地确定关键生物过程(例如发育和对压力的反应)背后的基因表达水平是合乎逻辑的。在此,我们重点关注植物表观转录组与涉及 DNA 修饰、组蛋白修饰和非编码 RNA 的表观遗传调控之间串扰的新证据。
B7/CD28 和 EGFR 通路之间的串扰
摘要表皮生长因子受体 (EGFR) 中的体细胞激活突变是癌症(例如非小细胞肺癌 (NSCLC)、转移性结直肠癌、胶质母细胞瘤、头颈癌、胰腺癌和乳腺癌)中最常见的致癌驱动因素之一。针对 EGFR 信号通路的分子靶向药物已显示出强大的临床疗效,但患者不可避免地会出现获得性耐药。尽管针对 PD-1/PD-L1 的免疫检查点抑制剂 (ICI) 在多种癌症类型的部分患者中表现出持久的抗肿瘤反应,但它们对含有 EGFR 激活基因变异的癌症的疗效有限。越来越多的研究表明,新的 B7/CD28 家族成员(如 B7-H3、B7x 和 HHLA2)的上调与 EGFR 信号传导有关,并可能通过创建免疫抑制肿瘤微环境 (TME) 导致对 EGFR 靶向疗法的耐药性。在本综述中,我们讨论了 EGFR 信号传导对 PD-1/PD-L1 通路和新的 B7/CD28 家族成员通路的调节作用。了解这些相互作用可能有助于制定联合治疗策略,并可能克服当前对 EGFR 靶向疗法的耐药性挑战。我们还总结了抗 PD-1/PD-L1 疗法在 EGFR 突变癌症中的临床数据,以及
通过精细成型的遮光矩阵减轻 122% NTSC 色域的彩色转换微型 LED 显示器的串扰效应
由于微型 LED 芯片具有广视角特性,制造高色域色彩转换微型发光二极管 (LED) 显示器面临的主要挑战之一是相邻像素之间严重的串扰效应。本研究系统地模拟了导致串扰效应的潜在因素。我们观察到,用遮光矩阵 (LBM) 精确填充每个微型 LED 芯片之间的空间可以成为缓解这种风险的有效解决方案。经过仔细研究,证明了压模辅助成型技术是制造 LBM 的有效方法。然而,实验观察进一步表明,微型 LED 表面残留的黑色 LBM 会严重降低亮度,从而影响显示性能。通过采用等离子蚀刻技术有效提取被捕获的光,成功解决了这个问题。最终,开发了一种顶部发射蓝色微型 LED 背光,该背光采用黑色 LBM 精细成型,并与红色和绿色量子点色彩转换层相结合,实现全彩色显示。我们制造的显示器原型的色域可覆盖国家电视标准委员会的122%。
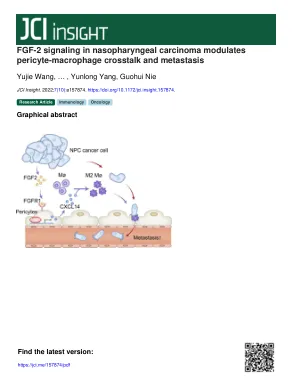
鼻咽癌中的FGF-2信号传导调节周围巨噬细胞串扰和转移
引言鼻咽癌(NPC)在2018年占73,000人死亡,东南亚的发病率最高(1,2)。通常在NPC发育中促成因素,包括爱泼斯坦 - 巴尔病毒(EBV)感染,遗传易感性和生活方式(2)。在临床上,放疗和化学疗法是针对早期NPC和非转移性NPC患者进行的(3)。但是,转移性NPC患者的治疗选择有限。转移性NPC似乎是一组具有广泛存活的肿瘤,肺,肝脏和骨骼是远处转移的最常见部位(4)。靶向治疗被认为是进一步延长NPC患者存活的有效方法。尽管如此,几项临床试验表明,与传统的化学治疗疗法相比,靶向Bevacizumab的血管内皮生长因子(VEGF)SIG-NALINing或靶向cetuximab的靶向表皮生长因子(EGF)信号传导,并未显示NPC患者的临床益处(5-7)。因此,迫切需要对NPC的Novel分子靶向疗法。NPC转移的机械研究是开发新的靶向疗法的基础。目前,NPC转移研究主要是
鼻咽癌中的 FGF-2 信号调节周细胞-巨噬细胞串扰和转移
引言鼻咽癌(NPC)在2018年造成73,000人死亡,东南亚的发病率最高(1,2)。鼻咽癌发展的常见因素包括爱泼斯坦-巴尔病毒(EBV)感染、遗传易感性和生活方式(2)。临床上,放疗和化疗是推荐用于早期鼻咽癌和非转移性鼻咽癌患者(3)。然而,转移性鼻咽癌患者的治疗选择有限。转移性鼻咽癌似乎是一类异质性肿瘤,生存范围广泛,肺、肝和骨是远处转移最常见的部位(4)。靶向治疗被公认为进一步延长鼻咽癌患者生存的有效方法。然而,多项临床试验表明,与常规放化疗相比,针对血管内皮生长因子 (VEGF) 信号的贝伐单抗或针对表皮生长因子 (EGF) 信号的西妥昔单抗在鼻咽癌患者中未显示出临床益处 (5–7)。因此,迫切需要开发针对鼻咽癌的新型分子靶向治疗。鼻咽癌转移机制研究是开发新型靶向治疗的基础。目前,鼻咽癌转移研究主要集中在