XiaoMi-AI文件搜索系统
World File Search System亚硝胺 EMEA-H-A5(3)-1490 - 评估报告
2.3.2. 样品制备程序 ................................................................................................ 26 2.3.3. 导致错误分析结果的潜在原因 .............................................................................. 28 2.3.4. 内标 .............................................................................................................. 29 2.3.5. 质谱检测设备的优势 ...................................................................................... 29 2.3.6. OMCL 中当前使用的方法 ............................................................................. 29 2.3.7. 分析方法的灵敏度 ............................................................................................. 30 2.3.8. 关于分析方面的讨论 ............................................................................................. 31 2.4. 在药品中检测到 N-亚硝胺时计算暴露患者风险的注意事项 ............................................................................................. 31 2.4.1. N-亚硝胺的背景暴露 ............................................................................................. 31 2.4.2. 2.4.3. N-亚硝胺的致突变性和致癌性 .......................................................................................... 37 2.4.4. 使用体外致突变性数据对 N-亚硝胺进行致癌性等级排序 ............................................................................................. 41 2.4.5. 计算人类超额风险的通用方法 ............................................................................................. 43 2.4.6. 流行病学研究文献综述 ............................................................................................................. 44 2.5. 确定 N-亚硝胺限量的方法 ............................................................................................. 48 2.5.1. 单个亚硝胺限量、多个 N -亚硝胺限量和短于寿命(LTL)方法 ............................................................................................................. 48 2.5.2. 没有足够物质特定数据的亚硝胺限量 ............................................................................................. 50 2.5.3.其他风险管理方法 ................................................................................................ 51 2.5.4. 比较设定限度的不同选项 .............................................................................. 52 2.6. 考虑进一步研究 .............................................................................................. 56 2.6.1. 考虑进一步进行非临床/临床研究 ...................................................................... 56 2.6.2. 考虑进一步进行流行病学研究 ...................................................................... 56 2.7. 与 CHMP 对含有四唑环沙坦类药物的意见的相关性 ............................................. 58
二甲双胍中亚硝胺杂质的检测方法
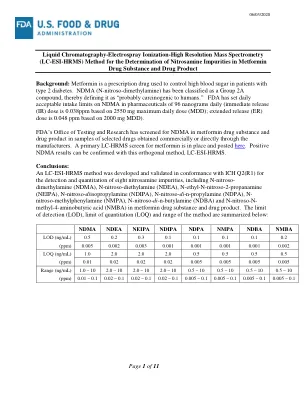
液相色谱-电喷雾电离-高分辨率质谱 (LC-ESI-HRMS) 法测定二甲双胍药物物质和药物产品中的亚硝胺杂质背景:二甲双胍是一种处方药,用于控制 2 型糖尿病患者的高血糖。NDMA(N-亚硝基二甲胺)被归类为 2A 类化合物,因此将其定义为“可能对人类致癌”。FDA 已将药品中 NDMA 的每日可接受摄入量限制为 96 纳克(基于 2550 毫克最大日剂量 (MDD),速释 (IR) 剂量为 0.038 ppm;基于 2000 毫克 MDD,缓释 (ER) 剂量为 0.048 ppm)。FDA 检测与研究办公室已在通过制造商商业购买或直接获得的选定药品样品中筛查了二甲双胍药物物质和药物产品中的 NDMA。已建立二甲双胍的初级 LC-HRMS 筛选并发布于此处。可以使用正交方法 LC-ESI-HRMS 确认阳性 NDMA 结果。结论:根据 ICH Q2(R1) 开发并验证了一种 LC-ESI-HRMS 方法,用于检测和定量二甲双胍药物物质和药物产品中的八种亚硝胺杂质,包括 N-亚硝基二甲胺 (NDMA)、N-亚硝基二乙胺 (NDEA)、N-乙基-N-亚硝基-2-丙胺 (NEIPA)、N-亚硝基二异丙胺 (NDIPA)、N-亚硝基二正丙胺 (NDPA)、N-亚硝基甲基苯胺 (NMPA)、N-亚硝基二正丁胺 (NDBA) 和 N-亚硝基-N-甲基-4-氨基丁酸 (NMBA)。该方法的检测限(LOD)、定量限(LOQ)和范围总结如下:
药物物质中的亚硝胺杂质 / LCMSTM-9030
引言自2018年起,美国FDA和其他国家的监管机构已警告某些原料药和产品中存在N-亚硝胺杂质。亚硝胺(NSA,见表1)是有毒化学物质,其中一些例如NDMA和NDEA被归类为可能的人类致癌物。NDMA和NDEA首次发现存在于血管紧张素II受体阻滞剂(ARB),如氯沙坦等原料药和产品中。在雷尼替丁和二甲双胍药品中发现了NDMA,由于NDMA含量超过可接受摄入量限值(AI,96 ng/天),因此产品被召回。利用高灵敏度和选择性的GC-MS、LC-MS/MS [1]和LC-HRMS [2-4]质谱方法,可以对药品中痕量NDMA和其他有关亚硝胺进行检测和定量。
遗传与分子毒理学
N-亚硝胺药物杂质是FDA关注的重点,尤其是由药物本身形成的亚硝胺杂质,称为N-亚硝胺药物相关杂质或NDSRI。杂质可以在药物生命周期的任何时间形成,例如作为合成副产物、在储存过程中以及在接受治疗的患者体内产生的NDSRI。使用突变试验可以识别可能增加癌症风险的N-亚硝胺杂质;具有致突变性的N-亚硝胺被认为是致癌物质,在药物中的含量被控制在非常低的水平。因此,FDA开发能够识别致突变N-亚硝胺的测试模型非常重要。DGMT科学家与药物评估和研究中心(CDER)亚硝胺药物杂质工作组合作,使用体外细菌和人类细胞突变试验评估一系列小分子N-亚硝胺和NDSRI的致突变性和遗传毒性。此外,还使用二维 (2D) 和三维 (3D) 人类肝细胞 (HepaRG) 模型测试了八种不同的 N-亚硝胺的遗传毒性。最后,对不同的 N-亚硝胺在转基因啮齿动物中的致癌性进行了评估。这些研究的目的是开发筛选和后续检测方法,以高置信度确定 N-亚硝胺药物杂质的癌症风险。以下出版物描述了这些研究的结果:Regul Toxicol Pharm 和 Arch Toxicol。
有关利托那韦的新兴科学技术信息
亚硝胺药物相关杂质 (NDSRI) 是一类 N -亚硝胺 (亚硝胺) 杂质,其结构与药品中的活性药物成分 (API) 相似。(请参阅 FDA 关于人用药物中亚硝胺杂质的行业控制指南(2024 年 9 月)、亚硝胺药物相关杂质 (NDSRI) 的推荐可接受摄入量限值(2023 年 8 月)、CDER 亚硝胺杂质可接受摄入量限值(2024 年 10 月))。FDA 正在告知含利托那韦产品的制造商和申请人,包括那些正在等待 FDA 审批的申请的制造商和申请人,FDA 对此类药品中可能存在的亚硝胺杂质的担忧。亚硝胺杂质含有亚硝基,因此它们被归类为 M7(R2) DNA 反应性杂质指南中所述的高致癌性“关注群体”。(请参阅 FDA 行业指南 M7(R2)《评估和控制药品中的 DNA 反应性(致突变性)杂质以限制潜在致癌风险》(2023 年 7 月))。
药物中的杂质亚硝胺;健康风险评估与缓解研讨会第一天
• 已知的 300 多种 NOC 在动物实验中超过 90% 具有致癌性。• NDMA、NDEA 和烟草特有的 NOC(如 NNK)对非常广泛的动物物种产生致癌作用,甚至包括亚人类灵长类动物。没有发现任何物种具有抗性。• 结构-活性研究有助于确定导致致癌性的结构元素,反之亦然,有助于确定消除致癌性的结构元素。• NOC 的有机向性作用是此类化合物的一个特征:肿瘤可在靶器官中特异性诱发,包括肺、鼻腔、食道、胃、胰腺、结肠、膀胱、中枢神经系统。• NOC 的生物活化及其与关键细胞靶标的相互作用在动物和人体组织中基本相似。
ICH M7 EWG 小组工作计划 2024 年 10 月 01 日
2024 年 6 月 第 1 阶段(2 年或更短时间达到第 1 步和第 2 步) 设计和使用体外检测方法(例如 Ames 试验)区分致突变和非致突变亚硝胺的原则 根据结构活性关系 (SAR) 定义 AI 的原则(例如,考虑对亚硝胺分子结构特征的了解) 根据暴露对 AI 应用短于寿命 (LTL) 的调整,前提是有足够的科学数据。