XiaoMi-AI文件搜索系统
World File Search System兼容所有 TT RGB PLUS 电源
所有 Thermaltake TT RGB PLUS 产品均可连接到 Razer Chroma 生态系统。安装 TT RGB PLUS 软件和 Razer Synapse 3。
有向平面图中的多源多源最大流量
他们分别向所有来源和下沉,但这种减少并不能保留平面性。使用Orlin的算法进行稀疏图[21]导致O(n 2 / log N)的运行时间。对于少于u的整数容量,可以使用Goldberg and Rao [9]的算法,它导致O(n1。5 log n log u)。Miller和Naor [19]首先研究了具有多个来源和水槽的平面图中的最大流量。他们为所有水槽和来源都位于单个面边界的情况下给出了一种分裂和争议算法。插入Henzinger等人的线性最短路径算法。[12]产生O(n log n)的运行时间。Borradaile和Harutyunyan具有相同的运行时间的迭代算法[2]。Miller和Naor还为源头和水槽位于K不同面部边界的情况下提供了一种算法。使用O(n log N) - 时源单源单源单源最大流量算法和klein [3]产生O(k 2 n log 2 n)的运行时间。Miller和Naor表明,当知道多少商品在每个来源和每个水槽都产生/消耗时,可以找到一致的流量路由,而尊重ARC容量的一致路由可以降低到最短的最短路径[19],可以在O(n log 2 N/ log log 2 n/ log log log N n n/ log log N n n n n/ log log n n)时[20]。
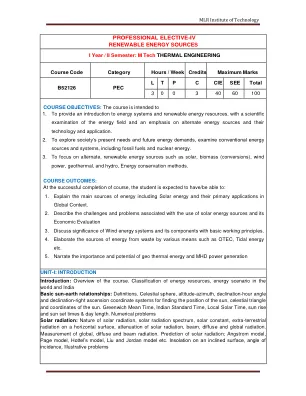
可再生能源 - 源 - (...
简介:课程概述。能源资源的分类,世界和印度基本的太阳 - 地球关系:定义。天体球,高度 - 齐路,偏斜角度和偏斜 - 右上角坐标系统,用于寻找太阳的位置,天体三角形和太阳的坐标。格林威治的平均时间,印度标准时间,当地太阳能时间,阳光升起和日光照射时间和日期。数值问题太阳辐射:太阳辐射的性质,太阳辐射谱,太阳常数,水平表面上的地球外辐射,太阳辐射的衰减,梁,弥散和全球辐射的衰减。全局,弥漫性和梁辐射的测量。太阳辐射的预测; Angstrom模型,页面模型,Hottel的模型,Liu和Jordan模型等。在倾斜的表面,入射角,说明性问题上的显影
在异源1
图1。异源IM/在促进型免疫中诱导了稳健的S蛋白质特异性IgG,并增强粘膜IgA的产生。(a)C57BL/6小鼠分开两次免疫接种4周。用0.25 µg的BNT162B2 mRNA或PBS将IM 182置入IM 182,或用NE 183或NE/IVT的15 µg全长S蛋白进行启动。然后用0.25 µg的BNT162B2 mRNA或PBS将IM升高,或者在PBS,NE或NE/IVT中使用184 PBS或S蛋白进行增强IM。血清抗原特异性的总IgG滴度185针对(b)WT的蛋白和(c)WT RBD,如ELISA 2WK在素数186免疫后通过ELISA 2WK所测量,以及(D,E)2WKS在WK6升高后的2wks。(F-H)在WK6测量的187种S特异性血清抗体的亚类谱。BALF S特异性(I)IgA和(J)IgG在188 wk6中测量。(n = 5/grp;*p <0.05,** p <0.01,**** p <0.0001,由Mann-Whitney U测试仅针对选择的189组显示 - (表S1显示了完整的统计分析)190
基于多源数据驱动
随着间歇性可再生能源(例如风能和太阳能)的大规模增长和网格连接,可再生能源降低速度和系统备份功能提高的问题已经变得越来越突出。为了解决高比例可再生能源科学消耗和能量系统的稳定运行的问题。我们提出了一种基于数据驱动的多区域电源系统的灵活且经济的调度方法。对于多区域电力系统的经济派遣问题,建立了数学计算模型,以满足单位输出,系统功率平衡,单位坡道速率和阀点效应的限制,并考虑将多区域功率负载的成本最小化。基于数据驱动的,本文采用了改进的水果优化算法来快速找到全球最佳解决方案。通过IEEE6仿真测试系统进行计算,结果验证了所提出的算法的可行性。考虑到获得的溶液的质量,比较了改进的水果优化算法并与其他算法进行了分析。结果显示了拟议算法在解决实际电力系统中多区域经济派遣问题方面的有效性和优势。
基于多源数据
摘要:地表城市热岛(Suhis)对于评估城市热环境至关重要。但是,Suhis的当前定量研究忽略了热辐射方向(TRD),这直接影响了研究精度。此外,他们无法评估不同土地利用强度对Suhis定量研究的TRD特征的影响。为了弥合这一研究差距,这项研究消除了2010 - 2020年Hefei(中国)的MODIS数据和空气温度数据,从MODIS数据和空气温度数据中量化了大气衰减和每日温度变化因子的干扰。通过比较Hefei的不同土地利用强度下的TRD来评估TRD对SUHI强度定量的影响。结果表明:(1)白天和夜间方向性最高可达到4.7 K和2.6 K,并分别发生在最高和中等城市土地使用强度的区域。(2)对于白天的城市表面,有两个显着的TRD热点,其中传感器天顶角与原来的太阳能天顶角大致相同,而传感器Zenith角度在下午的Nadir附近。(3)TRD可以根据卫星数据评估SUHI强度的结果2.0 K,这约占Hefei总SUHI的31-44%。
欧洲点源和直接源二氧化碳的可用性...
执行摘要 4 1. 介绍 9 2. 现有的二氧化碳市场 11 2.1 现有需求 12 2.1.1 现有的二氧化碳需求预测 13 2.2 现有的供应 13 2.2.1 现有的二氧化碳供应预测 14 3. 潜在的未来二氧化碳市场 15 3.1 潜在的未来二氧化碳需求 15 3.1.1 电子燃料、化学品和塑料 15 3.1.2 建筑材料 18 3.1.3 园艺(温室) 18 3.1.4 新兴需求预测 19 3.2 潜在的未来二氧化碳来源 22 3.2.1 点源:化石燃料和工业过程 22 3.2.2 生物源 24 3.2.3 直接空气捕获(DAC) 26 4. 二氧化碳平衡 29 4.1 DAC 二氧化碳需求量与电子煤油需求量 30 5. 直接空气捕获规模扩大 32 5.1 短期:2025 年和 2030 年 32 5.2 长期:2035 年至 2050 年 33 5.2.1 专家观点 34 5.2.2 增长率 34 5.2.3 二氧化碳捕获的平准化成本 38 5.2.4 能源需求 41 6. 二氧化碳利用率(按来源) 44 6.1 基于捕获成本的最佳二氧化碳来源 44 6.2 基于温室气体排放的最佳二氧化碳来源45 6.3 二氧化碳利用的地理、经济和监管考虑因素
DOP 作为海洋固氮菌的磷源和能量源的对比作用
海洋溶解有机磷 (DOP) 库主要由 P 酯组成,此外还有同样丰富的膦酸盐和 P 酐分子(数量较少)。在磷酸盐有限的海洋区域,固氮菌被认为依赖 DOP 化合物作为磷 (P) 的替代来源。虽然 P 酯和膦酸盐都能有效促进氮 (N 2 ) 固定,但 P 酐对固氮菌的作用尚不清楚。在这里,我们探讨了 P 酐对两个生物地球化学条件形成鲜明对比的站点的 N 2 固定的影响:一个位于汤加海沟火山弧地区(“火山”,磷酸盐含量低、铁浓度高),另一个位于南太平洋环流(“环流”,磷酸盐含量中等、铁含量低)。我们用 AMP(P 酯)、ATP(P 酯和 P 酐)或 3polyP(P 酐)培养表层海水,并确定了 Crocosphaera 和 Trichodesmium 中细胞特定的 N 2 固定率、nifH 基因丰度和转录。Trichodesmium 对添加的任何 DOP 化合物均无反应,这表明它们在火山站不受 P 限制,并且在环流站被低铁条件击败。相反,Crocosphaera 在两个站都数量众多,它们的特定 N 2 固定率在火山站受到 AMP 的刺激,在两个站受到 3polyP 的轻微刺激。尽管磷酸盐和铁的可用性形成对比,但两个站的异养细菌对 ATP 和 3polyP 添加的反应相似。 Crocosphaera 和异养细菌在低磷酸盐浓度和中等磷酸盐浓度下使用 3polyP 表明,这种化合物除了是 P 的来源外,还可用于获取两个群体竞争的能量。因此,P-酸酐可能会在未来分层和营养贫乏的海洋中利用能量限制来限制固氮菌。